Το Aflibercept αποτελεί ακόμη ένα όπλο στο μεταστατικού καρκίνο του παχέος εντέρου
Το Aflibercept έλαβε έγκριση στην Ευρωπαϊκή Ένωση για χορήγηση σε ασθενείς με μεταστατικό καρκίνο του παχέος εντέρου και ορθού που έχουν λάβει προηγούμενη θεραπεία.
– Ο πρώτος και μοναδικός παράγοντας που, χορηγούμενος σε συνδυασμό με το χημειοθεραπευτικό σχήμα FOLFIRI, μετά τη λήψη θεραπείας με βάση την οξαλιπλατίνη, βελτιώνει στατιστικώς σημαντικά την επιβίωση.
Παρίσι, Γαλλία και Tarrytown, Νέα Υόρκη – 5 Φεβρουαρίου 2013 – Η Sanofi και η Regeneron Pharmaceuticals Inc. ανακοίνωσαν ότι η Ευρωπαϊκή Επιτροπή χορήγησε άδεια κυκλοφορίας στην Ευρωπαϊκή Ένωση για το aflibercept 25mg/ml ενέσιμο διάλυμα για έγχυση σε συνδυασμό με το χημειοθεραπευτικό σχήμα FOLFIRI (5-φθοριοουρακίλη/ λευκοβορίνη/ιρινοτεκάνη) σε ενήλικες ασθενείς με μεταστατικό καρκίνο του παχέος εντέρου και του ορθού (mCRC), των οποίων η νόσος είναι ανθεκτική ή έχει υποτροπιάσει μετά τη λήψη θεραπείας με βάση την οξαλιπλατίνη. Αυτή η απόφαση βασίστηκε στα αποτελέσματα της μελέτης Φάσης III VELOUR σχετικά με την αποτελεσματικότητα και την ασφάλεια του συνδυασμού.
“Το Aflibercept αποτελεί μια σημαντική προσθήκη στο θεραπευτικό πεδίο του μεταστατικού καρκίνου του παχέος εντέρου και βοηθά να καλυφθεί ένα κρίσιμο θεραπευτικό κενό “, δήλωσε ο Eric Van Cutsem, M. D., Ph.D., University Hospitals Leuven, Βέλγιο και κύριος ερευνητής της μελέτης VELOUR. “Το Aflibercept είναι ο πρώτος και μοναδικός παράγοντας που παρουσιάζει στατιστικώς σημαντική βελτίωση της επιβίωσης, σε μια κλινική μελέτη φάσης ΙΙΙ σε ασθενείς που είχαν προηγουμένως λάβει θεραπεία με βάση την οξαλιπλατίνη και αντιμετωπίζονταν πλέον με το χημειοθεραπευτικό σχήμα FOLFIRI για τη μεταστατική τους νόσο.”
Στην Ευρώπη, ο καρκίνος του παχέος εντέρου είναι η πιο συνήθης μορφή καρκίνου σε άνδρες και γυναίκες και η δεύτερη κυριότερη αιτία θανάτου από καρκίνο. Το 2008, διαγνώστηκαν 436.000 νέα περιστατικά και 212.000 άνθρωποι έχασαν τη ζωή τους εξαιτίας του καρκίνου του παχέος εντέρου.[1]
“Θα ήθελα να ευχαριστήσω τους ιατρούς, τους ασθενείς και τις οικογένειές τους για την υποστήριξή τους στην ανάπτυξη του Aflibercept μέσω της διαδικασίας των κλινικών μελετών που οδήγησε στη λήψη έγκρισης στην Ευρώπη”, δήλωσε ο Debasish Roychowdhury, M. D., Senior Vice President και Επικεφαλής του Τομέα Ογκολογίας της Sanofi. “Είμαστε κατενθουσιασμένοι που προσφέρουμε μια νέα θεραπεία που παρατείνει τη ζωή των ασθενών με μεταστατικό καρκίνο του παχέος εντέρου και του ορθού και προσβλέπουμε σε συνεργασία με τις ευρωπαϊκές υγειονομικές αρχές ώστε να διασφαλίσουμε την πρόσβαση των ασθενών στο Aflibercept “
Σχολιάζοντας τη χορήγηση άδειας κυκλοφορίας, ο George D. Yancopoulos, M.D., Ph.D., Chief Scientific Officer της Regeneron και Πρόεδρος των Εργαστηρίων της Regeneron (Regeneron Laboratories), πρόσθεσε: “Η έγκριση του Aflibercept από την Ευρωπαϊκή Επιτροπή προσφέρει μια νέα επιλογή για την αντιμετώπιση της ακάλυπτης ιατρικής ανάγκης σε αυτό τον πληθυσμό ασθενών. Συνεχίζει να υφίσταται ανάγκη για ανάπτυξη νέων θεραπειών για την αντιμετώπιση του καρκίνου, και η Regeneron και η Sanofi έχουν δεσμευτεί να ανακαλύπτουν καινοτόμες ερευνητικές θεραπευτικές αγωγές και θεραπευτικούς συνδυασμούς.”
Το Aflibercept εγκρίθηκε από τον Οργανισμό Τροφίμων και Φαρμάκων (FDA) των ΗΠΑ τον Αύγουστο του 2012, μετά από διαδικασία αξιολόγησης κατά προτεραιότητα (Priority Review), ενώ αιτήσεις άδειας κυκλοφορίας για το Aflibercept βρίσκονται υπό αξιολόγηση και από άλλες ρυθμιστικές αρχές ανά τον κόσμο.
Σχετικά με τη Φάσης ΙΙΙ Μελέτη VELOUR
Η έγκριση του Aflibercept βασίστηκε σε δεδομένα από την κεντρική μελέτη Φάσης III VELOUR, μια πολυεθνική, τυχαιοποιημένη, διπλή τυφλή μελέτη που σύγκρινε τη χορήγηση του σχήματος FOLFIRI σε συνδυασμό είτε με Aflibercept είτε με εικονικό φάρμακο (placebo) στην αντιμετώπιση ασθενών με μεταστατικό καρκίνο παχέος εντέρου και ορθού (mCRC). Στη μελέτη τυχαιοποιήθηκαν 1.226 ασθενείς με μεταστατικό καρκίνο παχέος εντέρου και ορθού που προηγουμένως είχαν λάβει θεραπεία με βάση την οξαλιπλατίνη. Είκοσι-οκτώ τοις εκατό των ασθενών της μελέτης είχαν λάβει προηγούμενη θεραπεία με μπεβασιζουμάμπη. Το πρωτεύον καταληκτικό σημείο ήταν η συνολική επιβίωση. Δευτερεύοντα καταληκτικά σημεία συμπεριλάμβαναν την επιβίωση χωρίς εξέλιξη της νόσου, τη συνολική ανταπόκριση στη θεραπεία και την ασφάλεια.
Η κλινική μελέτη VELOUR έδειξε ότι σε ασθενείς που είχαν προηγουμένως λάβει θεραπεία με βάση την οξαλιπλατίνη, η προσθήκη του Aflibercept στο χημειοθεραπευτικό σχήμα FOLFIRI βελτίωσε στατιστικώς σημαντικά τη διάμεση επιβίωση από 12,06 μήνες σε 13,50 μήνες (HR=0,817 (95% CI 0,714 έως 0,935; p=0,0032), μια μείωση του σχετικού κινδύνου θανάτου κατά 18%. Παρατηρήθηκε επίσης στατιστικώς σημαντική βελτίωση στην επιβίωση χωρίς εξέλιξη της νόσου από 4,67 μήνες σε 6,90 μήνες (HR=0,758 95% CI 0.661 έως 0,869; p=0,00007), μια μείωση σχετικού κινδύνου κατά 24%. Το ποσοστό συνολικής ανταπόκρισης στην ομάδα που έλαβε Aflibercept σε συνδυασμό με FOLFIRI ανήλθε σε 19,8% έναντι 11,1% για την ομάδα που έλαβε θεραπεία μόνο με FOLFIRI (p=0,0001).
Οι πιο συχνές ανεπιθύμητες ενέργειες (όλων των βαθμών, με συχνότητα εμφάνισης ≥20%) που αναφέρθηκαν με υψηλότερη συχνότητα εμφάνισης (2% ή μεγαλύτερη διαφορά μεταξύ των ομάδων) στην ομάδα θεραπείας με Aflibercept /FOLFIRI, και κατά σειρά μειωμένης συχνότητας, ήταν λευκοπενία, διάρροια, ουδετεροπενία, πρωτεϊνουρία, αυξημένα επίπεδα ασπαρτικής αμινοτρανσφεράσης (AST), στοματίτιδα, κόπωση, θρομβοπενία, αυξημένα επίπεδα αμινοτρανσφεράσης της αλανίνης (ALT), υπέρταση, απώλεια βάρους, μειωμένη όρεξη, επίσταξη, κοιλιακό άλγος, δυσφωνία, αυξημένη κρεατινίνη ορού και κεφαλαλγία. Οι πιο συχνές ανεπιθύμητες ενέργειες βαθμού 3-4 (συχνότητα εμφάνισης ≥5%) που αναφέρθηκαν σε υψηλότερο ποσοστό εμφάνισης (2% ή μεγαλύτερη διαφορά μεταξύ των ομάδων) στην ομάδα θεραπείας με Aflibercept /FOLFIRI, και κατά σειρά μειωμένης συχνότητας, ήταν ουδετεροπενία, διάρροια, υπέρταση, λευκοπενία, στοματίτιδα, κόπωση, πρωτεϊνουρία και εξασθένηση.
Σχετικά με το Aflibercept
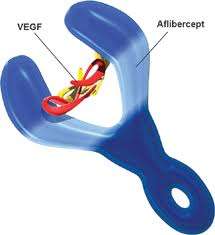
Το Aflibercept είναι μια ανασυνδυασμένη πρωτεΐνη σύντηξης που δρα ως υποδοχέας-παγίδα (decoy receptor) και δεσμεύει τον αγγειακό ενδοθηλιακό αυξητικό παράγοντα Α (VEGF-A), τον VEGF-B και τον αυξητικό παράγοντα του πλακούντα (PIGF). Ο VEGF-A είναι ένας εκ των μεσολαβητών που συμβάλλουν στην αγγειογένεση. Ο VEGF-B και ο PlGF, συγγενείς αυξητικοί παράγοντες που ανήκουν στην οικογένεια των VEGF, είναι δυνατό να συμβάλλουν επίσης στην αγγειογένεση του όγκου. Στις ΗΠΑ, το Aflibercept είναι κατοχυρωμένο εμπορικό σήμα της Regeneron Pharmaceuticals, Inc.
Στις ΗΠΑ, το Aflibercept έχει εγκριθεί με την κοινόχρηστη ονομασία ziv-aflibercept. Η διεθνής κοινόχρηστη ονομασία για το aflibercept, σύμφωνα με τη σύσταση του Παγκόσμιου Οργανισμού Υγείας (ΠΟΥ), είναι aflibercept. Αιτήσεις άδειας κυκλοφορίας για το Aflibercept έχουν κατατεθεί και
βρίσκονται υπό αξιολόγηση από άλλες ρυθμιστικές αρχές ανά τον κόσμο.
Σχετικά με τον καρκίνο του παχέος εντέρου
Παγκοσμίως, ο καρκίνος του παχέος εντέρου και ορθού αποτελεί τον τρίτο σε συχνότητα διάγνωσης καρκίνο στον ανδρικό πληθυσμό και τον δεύτερο στο γυναικείο πληθυσμό, με πάνω από 1,2 εκατομμύρια νέα περιστατικά να καταγράφονται το 2008. Ο καρκίνος του παχέος εντέρου και ορθού, μια από τις συχνότερες αιτίες θανάτου λόγω καρκίνου, μόνο το 2008 οδήγησε σε περισσότερους από 600.000 θανάτους σε ολόκληρο τον κόσμο. Σύμφωνα με την Αμερικανική Ογκολογική Εταιρεία (American Cancer Society), η διάγνωση περίπου του 60% των περιστατικών καρκίνου του παχέος εντέρου και ορθού πραγματοποιείται σε τοπικά προχωρημένο ή μεταστατικό στάδιο. Παρόλο που το ποσοστό επιβίωσης στο πρώιμο στάδιο της νόσου είναι σχετικά υψηλό, από τη στιγμή που ο καρκίνος του παχέος εντέρου παρουσιάσει μετάσταση σε απομακρυσμένα όργανα, το ποσοστό πενταετούς επιβίωσης εκτιμάται στο 12%.
Σχετικά με τον Τομέα Ογκολογίας της Sanofi
Με έδρα στο Κέιμπριτζ της Μασαχουσέτης (ΗΠΑ) και το Βιτρύ της Γαλλίας, ο Τομέας Ογκολογίας της Sanofi έχει αφιερωθεί στη μετουσίωση της επιστήμης σε αποτελεσματικές θεραπευτικές λύσεις, με στόχο την κάλυψη των ιατρικών αναγκών για ασθενείς με καρκίνο και μεταμοσχευμένους ασθενείς. Ξεκινώντας από την σε βάθος κατανόηση της νόσου και του ασθενή, ο Τομέας Ογκολογίας της Sanofi εφαρμόζει καινοτόμες προσεγγίσεις στην ανακάλυψη νέων φαρμάκων και την κλινική ανάπτυξή τους, με απώτατο σκοπό την προσφορά των κατάλληλων φαρμάκων στους κατάλληλους ασθενείς, για να τους βοηθήσει να ζήσουν μία μακρόχρονη και με καλύτερη κατάσταση υγείας ζωή. Πιστεύουμε στην αξία των συνεργασιών που συνδυάζουν το επιστημονικό κύρος της εταιρείας μας με αυτό των ειδικών στο πεδίο της βιομηχανίας και της ακαδημαϊκής κοινότητας. Το χαρτοφυλάκιό μας περιλαμβάνει 10 προϊόντα που διατίθενται στην αγορά και περισσότερες από 15 υπό έρευνα ουσίες που βρίσκονται στο στάδιο της κλινικής ανάπτυξης, συμπεριλαμβανομένων μικρομοριακών και βιολογικών παραγόντων.
Σχετικά με τη Sanofi
Η Sanofi κατέχει ηγετική θέση στον Τομέα της Υγείας παγκοσμίως, με πολυσχιδή δραστηριότητα, ανακαλύπτοντας, αναπτύσσοντας και παρέχοντας θεραπευτικές λύσεις εστιασμένες στις ανάγκες των ασθενών. Η Sanofi διαθέτει ισχυρή παρουσία στον Tομέα της Yγείας, με 7 πεδία ανάπτυξης: ολοκληρωμένες λύσεις για το Διαβήτη, εμβόλια για ανθρώπινη χρήση, καινοτόμα φάρμακα, καταναλωτικά προϊόντα υγείας, εστίαση στις αναδυόμενες αγορές, κτηνιατρικό τομέα και τη Genzyme. Η Sanofi είναι εισηγμένη στα Χρηματιστήρια του Παρισιού και της Νέας Υόρκης.
Σχετικά με τη Regeneron Pharmaceuticals Inc.
Η Regeneron είναι μία κορυφαία, βασιζόμενη στην επιστήμη βιοφαρμακευτική εταιρεία, με έδρα το Tarrytown στη Νέα Υόρκη, που ανακαλύπτει, εφευρίσκει, αναπτύσσει, παρασκευάζει και εμπορεύεται φαρμακευτικά προϊόντα για τη θεραπευτική αντιμετώπιση σοβαρών παθήσεων. Η Regeneron εμπορεύεται φαρμακευτικά προϊόντα για οφθαλμικές παθήσεις, καρκίνο του παχέος εντέρου και ορθού, και μια σπάνια φλεγμονώδη πάθηση και διαθέτει υπό ανάπτυξη προϊόντα για άλλα πεδία με ακάλυπτες ιατρικές ανάγκες, μεταξύ των οποίων η υπερχοληστερολαιμία, η ρευματοειδής αρθρίτιδα, το άσθμα και η ατοπική δερματίτιδα. Για πρόσθετες πληροφορίες σχετικά με την εταιρεία, παρακαλώ επισκεφθείτε την ηλεκτρονική διεύθυνση www.regeneron.com.
[1] ESMO Consensus Guidelines for management of pateints with colon and rectal cancer. A personalized approach to clinical decision making. Annals of Oncol. 2012; 23: 2470-2516