Η Novartis λαμβάνει έγκριση από τον FDA για το Zykadia™,
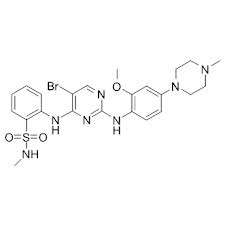
Η Novartis λαμβάνει έγκριση από τον FDA για το Zykadia™, την πρώτη θεραπεία για ασθενείς με ALK+ NSCLC στους οποίους έχει προηγουμένως χορηγηθεί ο αναστολέας της ALK crizotinib
- Το Zykadia (ceritinib) επέδειξε συνολικό ποσοστό ανταπόκρισης 54,6% σε ασθενείς με ALK+ μεταστατικό NSCLC, οι οποίοι δεν έχουν καμία άλλη θεραπευτική επιλογή
- Η διάμεση διάρκεια της ανταπόκρισης στο Zykadia ήταν 7,4 μήνες. Οι ασθενείς της μελέτης άρχισαν τη θεραπεία με μεταστάσεις, που περιελάμβαναν μεταστάσεις στον εγκέφαλο (60%), στο ήπαρ (42%) και στα οστά (42%)
- Ο ALK+ NSCLC προκύπτει από μία αναδιάταξη του γονιδίου ALK, το οποίο ευθύνεται για την ανάπτυξη των καρκινικών κυττάρων σε 2-7% των ασθενών με NSCLC
- Η έγκριση ακολουθεί το χαρακτηρισμό της Επαναστατικής Θεραπείας από τον FDA. Ρυθμιστικές αιτήσεις έχουν υποβληθεί στην ΕΕ και διαδικασίες έγκρισης βρίσκονται σε εξέλιξη με άλλες υγειονομικές αρχές παγκοσμίως
Η Novartis ανακοίνωσε ότι ο Οργανισμός Τροφίμων και Φαρμάκων των ΗΠΑ (FDA) ενέκρινε το Zykadia™ (ceritinib, γνωστό στο παρελθόν ως LDK378) για τη θεραπεία ασθενών με θετικό στην κινάση αναπλαστικού λεμφώματος (ALK+) μεταστατικό μη μικροκυτταρικό καρκίνο του πνεύμονα (NSCLC) που έχουν παρουσιάσει εξέλιξη της νόσου υπό αγωγή με crizotinib ή δυσανεξία στο crizotinib. Η έγκριση του Zykadia ικανοποιεί την ιατρική ανάγκη των ασθενών με αυτόν τον τύπο καρκίνου του πνεύμονα, οι οποίοι έχουν παρουσιάσει εξέλιξη με προηγούμενη θεραπεία.
«Το Zykadia αντιπροσωπεύει μία σημαντική θεραπευτική επιλογή για τους ασθενείς με ALK+ NSCLC, οι οποίοι υποτροπιάζουν μετά από την έναρξη της αρχικής θεραπείας με crizotinib», είπε η ερευνήτρια Alice T. Shaw, MD, PhD, Massachusetts General Hospital Cancer Center, Boston. «Η έγκριση αυτή θα επηρεάσει τον τρόπο με τον οποίο αντιμετωπίζουμε και παρακολουθούμε τους ασθενείς με αυτόν τον τύπο καρκίνου του πνεύμονα, καθώς πλέον θα είμαστε σε θέση να τους προσφέρουμε την ευκαιρία για συνεχή ανταπόκριση στη θεραπεία με έναν νέο αναστολέα της ALK».
Ο καρκίνος του πνεύμονα είναι η κύρια αιτία θανάτου από καρκίνο παγκοσμίως. Ο πιο συχνός τύπος καρκίνου του πνεύμονα είναι ο NSCLC, στον οποίο αντιστοιχεί το 85-90% όλων των περιπτώσεων. Από αυτές, 2-7% προκύπτουν από αναδιάταξη του γονιδίου ALK, η οποία αυξάνει την ανάπτυξη των καρκινικών κυττάρων και μπορεί να διαπιστωθεί με μία μοριακή εξέταση του καρκινικού όγκου. Παρά τις σημαντικές εξελίξεις στη θεραπεία των ασθενών με ALK+ NSCLC, η εξέλιξη της νόσου είναι συχνά αναπόφευκτη και χρειάζονται περισσότερες επιλογές.
Η έγκριση του Zykadia βασίζεται σε μία βασική μελέτη που συμπεριέλαβε 163 ασθενείς με μεταστατικό ALK+ NSCLC, οι οποίοι παρουσίασαν εξέλιξη της νόσου υπό αγωγή με crizotinib ή δυσανεξία στο crizotinib. Οι πιο συχνές περιοχές μεταστάσεων στον πληθυσμό των ασθενών που μελετήθηκαν ήταν ο εγκέφαλος (60%), το ήπαρ (42%) και τα οστά (42%).
Στους ασθενείς που είχαν λάβει αγωγή στο παρελθόν, το Zykadia πέτυχε ένα συνολικό ποσοστό ανταπόκρισης (ORR) 54,6% [95% CI, 47-62%] και μία διάμεση διάρκεια ανταπόκρισης (DOR) 7,4 μηνών [95% CI, 5,4-10,1 μήνες]. Οι πιο συχνές ανεπιθύμητες ενέργειες (επίπτωση τουλάχιστον 25%) ήταν διάρροια, ναυτία, αυξημένες τρανσαμινάσες, έμετος, κοιλιακό άλγος, κόπωση, μειωμένη όρεξη και δυσκοιλιότητα.
«Η έγκριση του Zykadia, λιγότερο από τριάμισι χρόνια μετά από την είσοδο του πρώτου ασθενούς στην κλινική μας μελέτη, αποτελεί παράδειγμα του τί είναι δυνατό να επιτευχθεί όταν υπάρχει υψηλά εστιασμένη προσέγγιση στην ανάπτυξη του φαρμάκου και ισχυρή συνεργασία», είπε ο Alessandro Riva, MD, Πρόεδρος, Novartis Oncology ad interim και Παγκόσμιος Επικεφαλής, Τμήμα Ογκολογίας και Ιατρικών Υποθέσεων. «Η αφοσίωση των κλινικών ερευνητών, των ασθενών, του FDA και άλλων μας έδωσε τη δυνατότητα να φέρουμε το φάρμακο αυτό στους ασθενείς που το έχουν ανάγκη το ταχύτερο δυνατό».
Το Zykadia είναι ένας χορηγούμενος από το στόμα, εκλεκτικός αναστολέας της ALK, ενός σημαντικού θεραπευτικού στόχου στον καρκίνο του πνεύμονα. Το ALK είναι ένα γονίδιο που μπορεί να συντηχθεί με άλλα γονίδια για να σχηματίσει μία αποκλίνουσα «πρωτεΐνη σύντηξης», που προωθεί την ανάπτυξη και την αύξηση των καρκινικών κυττάρων.Το Zykadia είναι ένα από τα πρώτα φάρμακα που εγκρίνονται ακολουθώντας τον ορισμό της Επαναστατικής Θεραπείας από τον FDA, που δόθηκε το Μάρτιο του 2013 λόγω της σημαντικότητας των αποτελεσμάτων που παρατηρήθηκαν στην κύρια μελέτη και της σοβαρής και απειλητικής για τη ζωή φύσης του ALK+ NSCLC. Επιπρόσθετες αιτήσεις για το Zykadia έχουν υποβληθεί σε ρυθμιστικές αρχές παγκοσμίως, ενώ αίτηση έχει υποβληθεί αυτή τη στιγμή και στην Ευρωπαϊκή Ένωση.