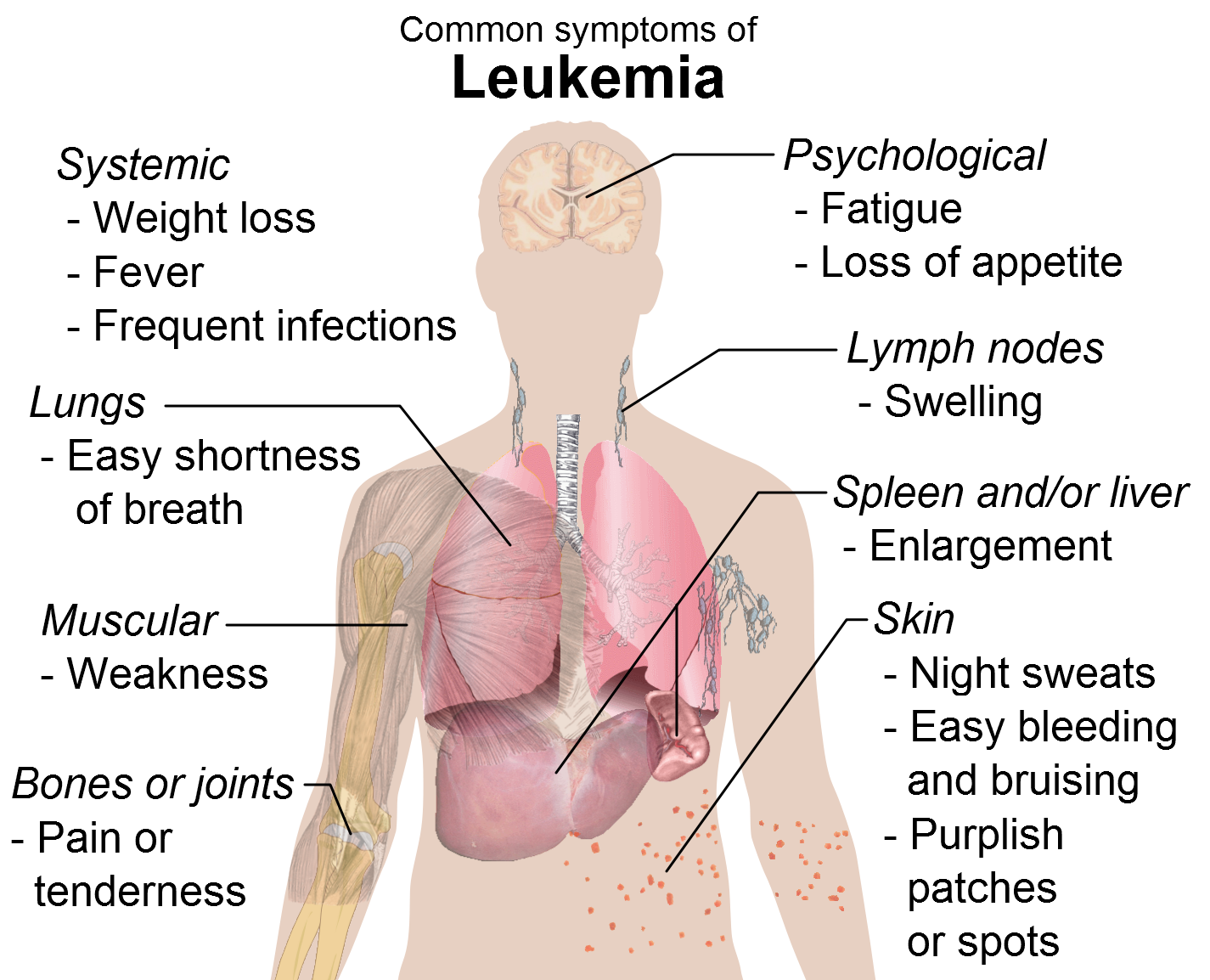
Θετική Γνωμοδότηση έλαβε η ιμπρουτινίμπη σε Ασθενείς με Χρόνια Λεμφοκυτταρική Λευχαιμία

Η ιμπρουτινίμπη έλαβε τη Θετική Γνωμοδότηση της CHMP Για Επέκταση της Χρήσης σε Ασθενείς με Χρόνια Λεμφοκυτταρική Λευχαιμία Που Δεν Έχουν Λάβει Προηγούμενη Θεραπεία.
Η σύσταση βασίστηκε στην μελέτη RESONATE™-2 που παρουσίασε ότι η ιμπρουτινίμπη βελτίωσε σημαντικά την επιβίωση χωρίς εξέλιξη της νόσου και παρέτεινε τη συνολική επιβίωση σε σύγκριση με την χλωραμβουκίλη.
Η Janssen-Cilag International NV ανακοίνωσε ότι η Επιτροπή Φαρμακευτικών Προϊόντων για Ανθρώπινη Χρήση (CHMP) του Ευρωπαϊκού Οργανισμού Φαρμάκων (EMA) υιοθέτησε Θετική Γνωμοδότηση, συνιστώντας τη επέκταση της υπάρχουσας άδειας κυκλοφορίας για την ιμπρουτινίμπη για εναλλακτική ένδειξη: θεραπεία ενήλικων ασθενών με χρόνια λεμφοκυτταρική λευχαιμία (ΧΛΛ) που δεν έχουν λάβει προηγούμενη θεραπεία.
Η ιμπρουτινίμπη έχει εγκριθεί για τη θεραπεία ενήλικων ασθενών με υποτροπιάζον ή ανθεκτικό στη θεραπεία για λέμφωμα από κύτταρα μανδύα (ΛΚΜ) ή ενήλικων ασθενών με χρόνια λεμφοκυτταρική λευχαιμία (ΧΛΛ) που έχουν λάβει τουλάχιστον μία προηγούμενη θεραπεία ή ως πρώτη γραμμή θεραπείας κατά την παρουσία εξάλειψης του 17p ή μετάλλαξης του TP53 (γενετικές μεταλλάξεις που συνήθως σχετίζονται με κακές εκβάσεις θεραπείας) για ασθενείς που δεν είναι κατάλληλοι για χημειοανοσοθεραπεία.1
Η Θετική Γνωμοδότηση της CHMP βασίστηκε σε δεδομένα από την τυχαιοποιημένη, ανοικτή μελέτη Φάσης 3 RESONATE™-2 (PCYC-1115), όπως δημοσιεύτηκαν προσφάτως στο The New England Journal of Medicine (NEJM).3 Τα ευρήματα έδειξαν ότι η ιμπρουτινίμπη προσέφερε σημαντική βελτίωση σε όλα τα καταληκτικά σημεία αποτελεσματικότητας σε σύγκριση με την χλωραμβουκίλη σε ασθενείς ηλικίας τουλάχιστον 65 ετών με πρόσφατη διάγνωση ΧΛΛ. Το ποσοστό επιβίωσης χωρίς εξέλιξη της νόσου (PFS) στους 18 μήνες ήταν 90 τοις εκατό για την ιμπρουτινίμπη σε σύγκριση με 52 τοις εκατό για την χλωραμβουκίλη.3 Η ιμπρουτινίμπη παρέτεινε, επίσης, σημαντικά τη συνολική επιβίωση (OS) (HR=0.16 τοις εκατό CI, 0.05, 0.56; P=0.001), με ποσοστό επιβίωσης στους 24 μήνες 98 τοις εκατό σε σύγκριση με 85 τοις εκατό για τους ασθενείς στο σκέλος της χλωραμβουκίλης.3 Η ασφάλεια της ιμπρουτινίμπης στον πληθυσμό των ασθενών με ΧΛΛ που δεν είχαν λάβει θεραπεία ήταν όμοια με αναφορές από προηγούμενες μελέτες.3
Η ΧΛΛ είναι μια χρόνια νόσος και το ποσοστό επιπολασμού στην Ευρώπη σε άνδρες και γυναίκες είναι περίπου 5,87 και 4,01 περιπτώσεις ανά 100.000 άτομα ανά έτος, αντίστοιχα. Η διάμεση συνολική επιβίωση κυμαίνεται μεταξύ 18 μηνών και πάνω από 10 ετών ανάλογα με το στάδιο της νόσου.2
Η Τζέιν Γκρίφιθς, Επικεφαλής του Ομίλου Εταιρειών, Janssen Ευρώπης, Μέσης Ανατολής και Αφρικής, δήλωσε: “Η Janssen είναι υπερήφανη που ωθεί την αλλαγή κάνοντας συνεχιζόμενες προσπάθειες προκειμένου να μεταμορφώσει την εμπειρία της θεραπείας για τους ασθενείς με δυσκολία στην αντιμετώπιση των αιματολογικών καρκίνων, όπως η ΧΛΛ. Η ιμπρουτινίμπη συνεχίζει να επιδεικνύει εντυπωσιακά κλινικά αποτελέσματα και τα δεδομένα στα οποία βασίστηκε αυτή η σύσταση για ακόμη μια φορά τονίζουν τις δυνατότητές της όσον αφορά τα αποτελέσματα στους ασθενείς.”
Αυτή η γνωμοδότηση-ορόσημο από τις ρυθμιστικές αρχές ακολουθεί την απόφαση της Υπηρεσίας Τροφίμων και Φαρμάκων των ΗΠΑ στις 04 Μαρτίου 2016, που ενέκρινε τη διευρυμένη χρήση καψακίων ιμπρουτινίμπης για τη θεραπεία ασθενών με ΧΛΛ που δεν έχουν λάβει προηγούμενη θεραπεία.
Σχετικά με την Ιμπρουτινίμπη
Η ιμπρουτινίμπη είναι ένας πρώτος στην κατηγορία του αναστολέας της τυροσινικής κινάσης του Bruton (BTK) που δρα δημιουργώντας ισχυρό ομοιοπολικό δεσμό με την BTK για να εμποδίσει την μετάδοση των σημάτων κυτταρικής επιβίωσης μέσα στα κακοήθη Β κύτταρα.4 Εμποδίζοντας αυτήν την πρωτεΐνη BTK, η ιμπρουτινίμπη βοηθάει στην εξουδετέρωση και τη μείωση του αριθμού των καρκινικών κυττάρων. Επίσης, καθυστερεί την επιδείνωση του καρκίνου.1
Η ιμπρουτινίμπη έχει εγκριθεί επί του παρόντος στην Ευρώπη για τη θεραπεία ενήλικων ασθενών με υποτροπιάζον ή ανθεκτικό στη θεραπεία λέμφωμα από κύτταρα μανδύα (ΛΚΜ), ενήλικων ασθενών με χρόνια λεμφοκυτταρική λευχαιμία (ΧΛΛ) που έχουν λάβει τουλάχιστον μία προηγούμενη θεραπεία ή ως θεραπεία πρώτης γραμμής ασθενών με ΧΛΛ κατά την παρουσία εξάλειψης του 17p ή μετάλλαξης του TP53 για ασθενείς που δεν είναι κατάλληλοι για χημειοανοσοθεραπεία και για ενήλικους ασθενείς με μακροσφαιριναιμία του Waldenström (WM) που έχουν λάβει τουλάχιστον μία προηγούμενη θεραπεία ή ως θεραπεία πρώτης γραμμής για ασθενείς που είναι ακατάλληλοι για χημειοανοσοθεραπεία.5 Δεν έχει ακόμα χορηγηθεί έγκριση από τις ρυθμιστικές αρχες για επιπρόσθετες χρήσεις. Σχεδιάζονται ερευνητικές χρήσεις της ιμπρουτινίμπης ως μονοθεραπεία και σε συνδυασμό με άλλες θεραπείες για αρκετούς καρκίνους του αίματος στους οποίους συμπεριλαμβάνονται τα ΧΛΛ, ΛΚΜ, WM, διάχυτο λέμφωμα από μεγάλα Β-κύτταρα (DLBCL), θυλακιώδες λέμφωμα (ΘΛ), πολλαπλό μυέλωμα (ΠΜ) και λέμφωμα μεθοριακής ζώνης (ΛΜΖ).
Η ιμπρουτινίμπη έχει αναπτυχθεί από κοινού από την Cilag GmbH International, που είναι μέλος των Φαρμακευτικών Εταιρειών Janssen και την Pharmacyclics LLC, μια εταιρεία της AbbVie. Οι θυγατρικές της Janssen διαθέτουν στην αγορά την ιμπρουτινίμπη στην περιοχή EMEA (Ευρώπη, Μέση Ανατολή και Αφρική) καθώς και στον υπόλοιπο κόσμο, εκτός από τις Ηνωμένες Πολιτείες, όπου την διαθέτουν στην αγορά από κοινού η Janssen Biotech, Inc. και η Pharmacyclics. Η Janssen και η Pharmacyclics συνεχίζουν ένα εκτενές πρόγραμμα κλινικής ανάπτυξης για την ιμπρουτινίμπη, που συμπεριλαμβάνει δεσμεύσεις για μελέτη Φάσης 3 σε πολλαπλούς πληθυσμούς ασθενών – μπορείτε να διαβάσετε την περίληψη χαρακτηριστικών του προϊόντος για την ιμπρουτινίμπη για περαιτέρω πληροφορίες.
Σχετικά με την RESONATE™-2
Τα ευρήματα της μελέτης RESONATE™-2 (PCYC-1115) έδειξαν ότι η ιμπρουτινίμπη προσέφερε σημαντική βελτίωση στην επιβίωση χωρίς εξέλιξη της νόσου και σε άλλα βασικά κλινικά καταληκτικά σημεία σε σύγκριση με την χλωραμβουκίλη σε ασθενείς ηλικίας τουλάχιστον 65 ετών με πρόσφατη διάγνωση ΧΛΛ. Το ποσοστό επιβίωσης χωρίς εξέλιξη της νόσου (PFS) στους 18 μήνες ήταν 90 τοις εκατό για την ιμπρουτινίμπη έναντι 52 τοις εκατό για την χλωραμβουκίλη.3 Η ιμπρουτινίμπη επίσης παρέτεινε σημαντικά τη συνολική επιβίωση (OS) (HR=0.16 τοις εκατό CI, 0.05, 0.56; P=0.001) με ποσοστό επιβίωσης στους 24 μήνες 98 τοις εκατό σε σύγκριση με 85 τοις εκατό για τους ασθενείς στο σκέλος της χλωραμβουκίλης.3
Η ασφάλεια της ιμπρουτινίμπης στον πληθυσμό ασθενών με ΧΛΛ που δεν είχαν λάβει προηγούμενη θεραπεία ήταν όμοια με τις αναφορές προηγούμενων μελετών.3,5 Οι ανεπιθύμητες αντιδράσεις (AR) που αναφέρθηκαν στη μελέτη RESONATE-2 αντανακλούν την έκθεση στην ιμπρουτινίμπη με διάμεση διάρκεια 17,4 μηνών έναντι διάμεσης έκθεσης στη χλωραμβουκίλη 7,1 μηνών: σχεδόν 2,5 φορές μεγαλύτερη διάρκεια έκθεσης για την ιμπρουτινίμπη.3 Οι πιο συχνές ανεπιθύμητες αντιδράσεις (≥20 τοις εκατό) οποιουδήποτε Βαθμού στην μελέτη RESONATE-2 για την ιμπρουτινίμπη ήταν διάρροια (42 τοις εκατό), κόπωση (30 τοις εκατό), βήχας (22 τοις εκατό) και ναυτία (22 τοις εκατό). Οι πιο συχνές μη αιματολογικές ανεπιθύμητες αντιδράσεις Βαθμού ≥3 ήταν σπάνιες με τέσσερα τοις εκατό μόνο (πνευμονία, υπέρταση και διάρροια).3
Σχετικά με την ΧΛΛ
Στους περισσότερους ασθενείς, η Χρόνια Λεμφοκυτταρική Λευχαιμία (ΧΛΛ) είναι σε γενικές γραμμές ένας καρκίνος του αίματος των λευκών αιμοσφαιρίων που ονομάζονται Β-λεμφοκύτταρα ο οποίος παρουσιάζει αργή ανάπτυξη.6 Η διάμεση ηλικία κατά τη διάγνωση είναι 72 έτη7 και τα ποσοστά επίπτωσης στους άνδρες και τις γυναίκες στην Ευρώπη είναι περίπου 5,87 and 4,01 περιπτώσεις ανά 100.000 άτομα ανά έτος, αντίστοιχα.8 Η ΧΛΛ είναι μια χρόνια νόσος. Η διάμεση συνολική επιβίωση κυμαίνεται μεταξύ 18 μηνών και πάνω από 10 ετών ανάλογα με το στάδιο της νόσου.2 Η νόσος τελικά επιδεινώνεται στην πλειονότητα των ασθενών και οι ασθενείς διαθέτουν λιγότερες επιλογές θεραπείας κάθε φορά. Συνήθως γίνεται συνταγογράφηση πολλών γραμμών θεραπείας στους ασθενείς καθώς εμφανίζουν υποτροπές ή αντοχή στις θεραπείες.
Σχετικά με τις Φαρμακευτικές Εταιρείες Janssen
Στις Φαρμακευτικές Εταιρείες Janssen [της Johnson & Johnson], εργαζόμαστε ώστε να δημιουργήσουμε έναν κόσμο χωρίς ασθένειες. Μας εμπνέει το να μεταμορφώνουμε ζωές μέσω της εύρεσης νέων και καλύτερων τρόπων πρόληψης, παρεμπόδισης, αντιμετώπισης και θεραπείας νόσων. Συγκεντρώνουμε τους πιο λαμπρούς επιστήμονες και ακολουθούμε τα πιο υποσχόμενα επιστημονικά δεδομένα. Στη Janssen συνεργαζόμαστε με όλο τον κόσμο για την υγεία όλων. Μάθετε περισσότερα στο www.janssen.com. Ακολουθήστε μας στο www.twitter.com/janssenEMEA για τα τελευταία νέα μας.
Η Cilag GmbH International, η Janssen Biotech, Inc. και η Janssen-Cilag International NV ανήκουν στις Φαρμακευτικές Εταιρείες Janssen της Johnson & Johnson.
Η Janssen στην Ογκολογία
Στον τομέα της ογκολογίας στόχος μας είναι να αλλάξουμε θεμελιωδώς τον τρόπο κατανόησης, διάγνωσης και αντιμετώπισης του καρκίνου, ενισχύοντας τη δέσμευσή μας στους ασθενείς που μας εμπνέουν. Κατά την αναζήτηση καινοτόμων τρόπων αντιμετώπισης της πρόκλησης του καρκίνου οι βασικές μας προσπάθειες επικεντρώνονται σε πολλές λύσεις θεραπείας και πρόληψης. Σε αυτές περιλαμβάνεται η επικέντρωση στις αιματολογικές κακοήθειες, τον καρκίνο του προστάτη και τον καρκίνο του πνεύμονα, η παρεμπόδιση του καρκίνου με στόχο την ανάπτυξη προϊόντων που διακόπτουν την καρκινογόνο διεργασία, βιολογικοί δείκτες που μπορεί να συμβάλουν στην καθοδήγηση της στοχευμένης, εξατομικευμένης χρήσης των θεραπειών μας, καθώς και η ασφαλής και αποτελεσματική ταυτοποίηση και θεραπεία των πρώιμων μεταβολών στο μικροπεριβάλλον του όγκου.
Προειδοποιήσεις που αφορούν τις δηλώσεις σχετικά με το μέλλον
Αυτό το δελτίο τύπου περιέχει «δηλώσεις σχετικά με το μέλλον» όπως αυτές καθορίζονται από τον Νόμο του 1995 περί Αναμόρφωσης Δικαστικών Θεμάτων Ιδιωτικών Τίτλων σχετικά με [προσφάτως εγκεκριμένο προϊόν/την έγκριση νέας ένδειξης]. Ο αναγνώστης προειδοποιείται να μην βασίζεται σε αυτές τις δηλώσεις σχετικά με το μέλλον. Αυτές οι δηλώσεις βασίζονται στις τρέχουσες προσδοκίες μελλοντικών συμβάντων. Αν οι υποκείμενες εικασίες αποδειχθούν ανακριβείς ή αν υλοποιηθούν γνωστοί ή άγνωστοι κίνδυνοι ή αβεβαιότητες, τα πραγματικά αποτελέσματα θα μπορούσαν να διαφέρουν ουσιωδώς από τις προσδοκίες και προβλέψεις της [Εταιρείας Εκμετάλλευσης] ή/και της Johnson & Johnson. Οι κίνδυνοι και οι αβεβαιότητες περιλαμβάνουν μεταξύ άλλων τα εξής: αβεβαιότητα εμπορικής επιτυχίας∙ ανταγωνισμό, που περιλαμβάνει τις τεχνολογικές προόδους, τα νέα προϊόντα και τις πατέντες που επιτυγχάνουν οι ανταγωνιστές∙ αμφισβήτηση πατέντας∙ προβληματισμούς σχετικά με την αποτελεσματικότητα ή την ασφάλεια του προϊόντος με αποτέλεσμα τις ανακλήσεις προϊόντων ή τη λήψη μέτρων από τις ρυθμιστικές αρχές∙ αλλαγές στη συμπεριφορά και στα πρότυπα δαπανών ή οικονομική δυσπραγία των αγοραστών προϊόντων και υπηρεσιών φροντίδας υγείας∙ αλλαγές των ισχυόντων νόμων και κανονισμών, που περιλαμβάνουν τις μεταρρυθμίσεις της φροντίδας υγείας σε παγκόσμιο επίπεδο∙ δυσκολίες και καθυστερήσεις στην παραγωγή και τάσεις προς περιορισμό του κόστους φροντίδας υγείας. Ένας επιπλέον κατάλογος και περιγραφή αυτών των κινδύνων, αβεβαιοτήτων και άλλων παραγόντων υπάρχει στην Ετήσια Έκθεση της Johnson & Johnson‘s στο Έντυπο 10-K για το οικονομικό έτος που έληξε στις 3 Ιανουαρίου 2016, στο οποίο περιλαμβάνεται το Έκθεμα 99, καθώς και στις επακόλουθες αναφορές της εταιρείας προς την Επιτροπή Κεφαλαιαγοράς των ΗΠΑ. Αντίγραφα αυτών των αναφορών είναι διαθέσιμα διαδικτυακά στην διεύθυνση www.sec.gov, www.jnj.com ή κατόπιν αιτήματος προς την Johnson & Johnson. Καμία από τις Φαρμακευτικές Εταιρείες Janssen ούτε η Johnson & Johnson δεν αναλαμβάνουν να ενημερώσουν οποιαδήποτε δήλωση σχετικά με το μέλλον ως αποτέλεσμα νέων πληροφοριών ή μελλοντικών συμβάντων ή εξελίξεων.
Βιβλιογραφία
- European Medicines Agency. IMBRUVICA (ibrutinib). Available at: http://www.ema.europa.eu/ema/index.jsp?curl=pages/medicines/human/medicines/003791/human_med_001801.jsp&mid=WC0b01ac058001d124 Last accessed March 2016.
- Sagatys EM, Zhang L. Clinical and laboratory prognostic indicators in chronic lymphocytic leukemia. Cancer Control. 2012;19:18-25.
- Burger JA, Tedeschi A, Barr PM, et al. Ibrutinib vs chlorambucil in treatment-naïve chronic lymphocytic leukemia. N Engl J Med. 2015;373:2425-37.
- O’Brien S, Furman RR, Coutre SE, et al. Ibrutinib as initial therapy for elderly patients with chronic lymphocytic leukaemia or small lymphocytic lymphoma: an open-label, multicentre, phase 1b/2 trial. Lancet Oncol. 2014;15:48-58.
- Imbruvica summary of product characteristics, December 2015. Available at: http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Product_Information/human/003791/WC500177775.pdf Last accessed March 2016.
- American Cancer Society. Chronic lymphocytic leukemia detailed guide. Available at: http://www.cancer.org/acs/groups/cid/documents/webcontent/003111-pdf.pdf Last accessed March 2016.
- Eichhorst B, Dreyling M, Robak T, Montserrat E, Hallek M; ESMO Guidelines Working Group. Chronic lymphocytic leukemia: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2011;22(Suppl.6):vi50-vi54.
- Sant M, Allemani C, Tereanu C, et al. Incidence of hematologic malignancies in Europe by morphologic subtype: results of the HAEMACARE project. Blood. 2010;116:3724-34.