Θετικές εξελίξεις σε ασθενείς με προχωρημένο μελάνωμα!
Η Ευρωπαϊκή Επιτροπή εγκρίνει το pembrolizumab, την anti– PD-1 θεραπεία της MSD, για την αντιμετώπιση του προχωρημένου μελανώματος τόσο σε πρωτοθεραπευόμενους ασθενείς όσο και σε αυτούς που είχαν λάβει προηγουμένως άλλη θεραπεία.
Τα τελευταία χρόνια τα περιστατικά μελανώματος αυξάνονται, τόσο παγκοσμίως όσο και στην Ελλάδα. Στην Ευρώπη κάθε χρόνο καταγράφονται περισσότερα από 100.000 νέα περιστατικά αυτής της επιθετικής μορφής καρκίνου του δέρματος, ενώ στην Ελλάδα κάθε χρόνο διαγιγνώσκονται πάνω από 500 νέες περιπτώσεις (International Agency for Research on Cancer, 2012).
Υπάρχουν όμως και θετικές εξελίξεις, που αλλάζουν τελείως τα δεδομένα σε ασθενείς με προχωρημένο μελάνωμα. Η Ευρωπαϊκή Επιτροπή ενέκρινε τη δραστική ουσία pembrolizumab για την αντιμετώπιση του προχωρημένου (ανεγχείρητου ή μεταστατικού) μελανώματος σε ενήλικες, τόσο σε πρωτοθεραπευόμενους ασθενείς όσο και σε αυτούς που είχαν λάβει προηγουμένως άλλη θεραπεία.
Η νόσος
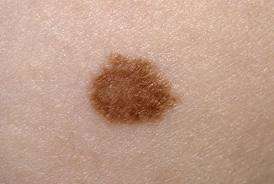
Το μελάνωμα είναι ένας κακοήθης όγκος, που μπορεί να αναπτυχθεί σε σπίλο που ήδη υπάρχει στο 30% των περιπτώσεων ή να εμφανιστεί εκ νέου σε φαινομενικά υγιές δέρμα. Οι πιο κοινές εντοπίσεις είναι ο κορμός στους άνδρες, τα κάτω άκρα και ο κορμός στις γυναίκες. Το μελάνωμα εμφανίζεται γενικά σα μία κηλίδα ή πλάκα ή οζίδιο με ποικίλα χρώματα και ασαφή όρια (υπουργείο Υγείας). Όταν η διάγνωση γίνεται σε πρώιμο στάδιο, η ίαση είναι πιθανή με τη χειρουργική αφαίρεση του μελανώματος. Δυστυχώς όμως η καθυστερημένη διάγνωση μπορεί να επιτρέψει τη διασπορά (μεταστάσεις) σε εσωτερικά όργανα και συνδέεται με πτωχή πρόγνωση. Τα 5-ετή ποσοστά επιβίωσης για το προχωρημένο μελάνωμα (Στάδιο 4) εκτιμώνται στο 15 με 20% στις Ηνωμένες Πολιτείες και στο 5 με 22% στην Ευρώπη. Επομένως, η πρόληψη είναι το πλέον, σταθερό και αποτελεσματικό εργαλείο που διαθέτουμε σήμερα για να αντιμετωπίσουμε το μελάνωμα.
Νέες θεραπευτικές εξελίξεις
Το pembrolizumab το οποίο έλαβε έγκριση από την Ευρωπαϊκή Επιτροπή, είναι η πρώτη και μοναδική anti-PD1 θεραπεία, η οποία ως μονοθεραπεία έδειξε στατιστικά ανώτερο όφελος επιβίωσης σε σύγκριση με το ipilimumab, την εγκαταστημένη θεραπεία του προχωρημένου μελανώματος. Η εν λόγω έγκριση επιτρέπει την εμπορική διάθεση του pembrolizumab και στα 28 κράτη-μέλη της ΕΕ, στην εγκεκριμένη δόση των 2 mg/kg ασθενούς και με συχνότητα χορήγησης ανά 3 εβδομάδες.
«To pembrolizumab είναι ένα φάρμακο που μπλοκάρει το κυτταρικό μονοπάτι που είναι γνωστό ως PD-1 (programmed cell death). Το PD-1 περιορίζει το ανοσοποιητικό σύστημα του ασθενούς να επιτεθεί στα κύτταρα του μελανώματος. Ο ΕΜΑ έδωσε έγκριση σ’ αυτήν την καινοτόμο θεραπεία επειδή αποτελέσματα κλινικών μελετών έδειξαν σημαντική βελτίωση συγκριτικά με τις άλλες θεραπείες», ανέφερε η κα Ελένη Γκόγκα, αναπληρώτρια καθηγήτρια Παθολογίας-Ογκολογίας, Ιατρικής Σχολής Πανεπιστημίου Αθηνών.
Σύμφωνα με τον κύριο Δημήτρη Μπαφαλούκο, ογκολόγο – παθολόγο, διευθυντή του Νοσοκομείου METROPOLITAN και πρόεδρο της Ελληνικής Εταιρίας Μελέτης Μελανώματος, «Εντυπωσιακή πρόοδος έχει επιτευχθεί τα τελευταία χρόνια στην θεραπεία του μεταστατικού μελανώματος. Ένας βασικός παράγων προόδου είναι η ανοσοθεραπεία και κυρίως τα anti-PD1 μονοκλωνικά αντισώματα. Το pembrolizumab είναι το πρώτο φάρμακο αυτής της κατηγορίας που εγκρίθηκε από τον FDA των ΗΠΑ για την θεραπεία του ανεγχείρητου μεταστατικού μελανώματος. Ασθενείς που είχαν προηγούμενα λάβει άλλες θεραπείες και είχαν υποτροπιάσει, ανταποκρίθηκαν σε ένα ποσοστό 38%. Το 60% δε των ασθενών επιβίωσε πέραν των 18μηνών. Είναι αξιοσημείωτο ότι το παραπάνω φάρμακο σε σύγκριση με την χημειοθεραπεία, έδειξε εντυπωσιακά καλύτερα αποτελέσματα στις ανταποκρίσεις, στο ελεύθερο νόσου διάστημα και στην επιβίωση με καλή ανοχή. Συμπερασματικά μια νέα εποχή επιτυχούς θεραπείας του μελανώματος έχει ξεκινήσει και η συνεχής και διαρκής έρευνα της ανοσοθεραπείας σε συνδυασμό με άλλες ειδικές θεραπείες θα βελτιώσει ακόμη περισσότερο τα αποτελέσματα, έτσι ώστε να επιτευχθεί ο απώτερος στόχος που είναι η μετατροπή του μεταστατικού μελανώματος σε χρόνια ή/και ιάσιμη νόσο».
Η έγκριση της Ευρωπαϊκής Επιτροπής για την pembrolizumab δόθηκε κατόπιν των αποτελεσμάτων που προέκυψαν από τρεις κλινικές μελέτες (KEYNOTE-001, KEYNOTE-002, KEYNOTE-006) στις οποίες συμμετείχαν περισσότεροι από 1.500 ασθενείς με προχωρημένο μελάνωμα. Στην KEYNOTE-001, την μεγαλύτερη μελέτη φάσης 1b που έχει γίνει μέχρι σήμερα για αντίσωμα anti–PD-1, το pembrolizumab κατέδειξε αντικειμενική ανταπόκριση που διαρκεί σε ασθενείς με προχωρημένο μελάνωμα. Στην KEYNOTE-002, μελέτη φάσης 2, φάνηκε ότι το pembrolizumab ήταν ανώτερο της χημειοθεραπείας στην επιβίωση χωρίς εξέλιξη της νόσου σε περιπτώσεις με προχωρημένο μελάνωμα που δεν ανταποκρίθηκαν στο ipilimumab. Στην KEYNOTE-006, μελέτη φάσης 3, φάνηκε ότι το pembrolizumab ήταν ανώτερο από το ipilimumab αναφορικά με την συνολική επιβίωση, την επιβίωση χωρίς εξέλιξη της νόσου και το συνολικό ποσοστό επιβίωσης. Μάλιστα η μελέτη KEYNOTE-006 διακόπηκε πρόωρα τον Μάρτιο του 2015 βάσει των συστάσεων της ανεξάρτητης Επιτροπής Επιτήρησης Δεδομένων της μελέτης, καθώς είχε επιτύχει τους δυο βασικούς της στόχους.
«Η σημερινή έγκριση από την ΕΕ υποστηρίζει περαιτέρω τον στόχο μας για επιτάχυνση της ανοσοσο-ογκολογικής έρευνας προς όφελος των ασθενών σε όλο τον κόσμο», δήλωσε ο Dr. Roger M. Perlmutter, πρόεδρος των ερευνητικών εργαστηρίων της MSD.
«Στην MSD πιστεύουμε εδώ και πολλά χρόνια ότι η καινοτομία και η πρόσβαση θα πρέπει να συμβαδίζουν. Για το λόγο αυτό αγωνιζόμαστε να προωθήσουμε καινοτόμες θεραπείες αλλά ταυτόχρονα να εξασφαλίσουμε και την πρόσβαση στις θεραπείες αυτές…» είπε ο Deepak Khanna, Α’ αντιπρόεδρος και περιφερειακός πρόεδρος της Ευρώπης στην MSD Oncology, για να συμπληρώσει ότι «…η MSD δεσμεύεται ότι θα συνεχίσει να συνεργάζεται στενά με κυβερνήσεις και άλλα ενδιαφερόμενα μέρη, έτσι ώστε να διασφαλίσει ότι το pembrolizumab θα είναι διαθέσιμο στους ασθενείς με προχωρημένο μελάνωμα στην Ευρώπη το συντομότερο δυνατόν».
Η θεραπεία κυκλοφορεί ήδη στις ΗΠΑ και τον Καναδά και χορηγείται κανονικά σε ασθενείς. Ο FDA είχε δώσει έγκριση στο pembrolizumab χαρακτηρίζοντάς το «καινοτόμα θεραπεία για το προχωρημένο μελάνωμα» (breakthrough therapy), με βάση τη σημαντικότητα των πρώιμων ευρημάτων από τις κλινικές μελέτες και κυρίως την επείγουσα ιατρική ανάγκη, αφού πρόκειται για μία νόσο με θεραπευτικό κενό.
Η MSD ηγείται ενός ταχύτατα αναπτυσσόμενου κλινικού προγράμματος στην ανοσο-ογκολογία με τη διεξαγωγή περισσότερων από 100 κλινικών μελετών σε ένα ευρύ φάσμα περισσότερων από 30 τύπων νεοπλασμάτων διαφορετικών σταδίων και γραμμών θεραπείας στο οποίο συμμετέχουν περισσότεροι από 16.000 ασθενείς. Το pembrolizumab μελετάται τόσο ως μονοθεραπεία όσο και σε συνδυασμό με άλλες θεραπείες.
H MSD Ελλάδας φροντίζει για την πρόσβαση των Ελλήνων ασθενών στο pembrolizumab μέσα από την υλοποίηση του προγράμματος διευρυμένης πρόσβασης και των κλινικών μελετών. Στην Ελλάδα αρκετοί ασθενείς έχουν ήδη πρόσβαση στη θεραπεία του pembrolizumab. Μετά την έγκριση του ΕΜΑ, δρομολογούνται και στην Ελλάδα οι απαραίτητες εγκρίσεις από τις ρυθμιστικές αρχές ώστε η πρόσβαση στο pembrolizumab να είναι σύντομα δυνατή από μεγαλύτερο αριθμό ασθενών και για όλους όσοι μπορεί να επωφεληθούν από την θεραπεία.
ΠΗΓΕΣ
Υπουργείο Υγείας.
http://www.moh.gov.gr/articles/news/1720-ellhnikh–ebdomada–kata–toy–karkinoy–toy–dermatos
International Agency for Research on Cancer (WHO) http://eco.iarc.fr/EUCAN/Country.aspx?ISOCountryCd=300#block-pie-a
http://eco.iarc.fr/EUCAN/Cancer.aspx?Cancer=20
Σχετικά με το pembrolizumab
Το pembrolizumab είναι ένα εξανθρωποιημένο μονοκλωνικό αντίσωμα που μπλοκάρει την αλληλεπίδραση μεταξύ PD-1 (προγραμματισμένος κυτταρικός θάνατος) και των συνδετών του PD-L1 και PD-L2. Με την κατάληψη του PD-1 υποδοχέα και με την παρεμπόδιση της αλληλεπίδρασης με τους συνδέτες, το pembrolizumab απελευθερώνει από την αναστολή ανοσοαπόκρισης μέσω του PD1, συμπεριλαμβανομένης και της αντικαρκινικής ανοσοαπόκρισης.
Με την απόφαση της Ευρωπαϊκής Επιτροπής, η θεραπεία με pembrolizumab εγκρίνεται τώρα σε περισσότερες από 35 χώρες για την αντιμετώπιση του προχωρημένου μελανώματος.
Εστιάζοντας στον Καρκίνο
Στο Τμήμα Ογκολογίας της MSD, ο στόχος μας είναι να μετατρέπουμε τα επαναστατικά επιτεύγματα της επιστήμης σε βιοϊατρικές καινοτομίες για να βοηθάμε τους ανθρώπους με καρκίνο σε όλο τον κόσμο. Πάθος μας είναι να στηρίζουμε τους ανθρώπους στον αγώνα τους ενάντια στον καρκίνο, σταθερή μας δέσμευση να ενισχύουμε την προσβασιμότητα στα φάρμακά μας και βασική μας προτεραιότητα να καινοτομούμε στην ανοσο-ογκολογική έρευνα δίνοντας περισσότερες ελπίδες στους ανθρώπους που πάσχουν από καρκίνο.
Σχετικά με την MSD
Η MSD (Merck Sharp & Dohme) ξεκίνησε τη λειτουργία της στην Ελλάδα τον Ιούνιο του 2010 απασχολώντας σήμερα περισσότερους από 230 υπαλλήλους. Αποτελεί θυγατρική εταιρεία του πολυεθνικού Ομίλου Merck & Co, με έδρα το Kenilworth του New Jersey που απασχολεί 74.000 εργαζομένους σε 140 χώρες σε όλο τον κόσμο. Η εταιρεία λειτουργεί με την ονομασία Merck στις Ηνωμένες Πολιτείες και τον Καναδά και με την ονομασία MSD στην Ευρώπη.
Η MSD (Merck Sharp & Dohme) είναι η δεύτερη μεγαλύτερη φαρμακευτική εταιρία παγκοσμίως. Στόχος της, να εκπληρώσει τη βασική της αποστολή: να είναι ο κόσμος καλά. Για περισσότερες πληροφορίες, επισκεφθείτε την ιστοσελίδα www.msd.gr.