Ελπίδες για τους ασθενείς με μυελοΐνωση από την έγκριση του Jakavi
Το φάρμακο της Novartis Jakavi® είναι το πρώτο που λαμβάνει έγκριση από την Ευρωπαϊκή Επιτροπή για την αντιμετώπιση ασθενών με μυελοΐνωση
Η έγκριση του Jakavi® (INC424, ruxolitinib) βασίστηκε στα αποτελέσματα από το πιο εκτεταμένο πρόγραμμα κλινικής μελέτης για τη μυελοΐνωση έως σήμερα
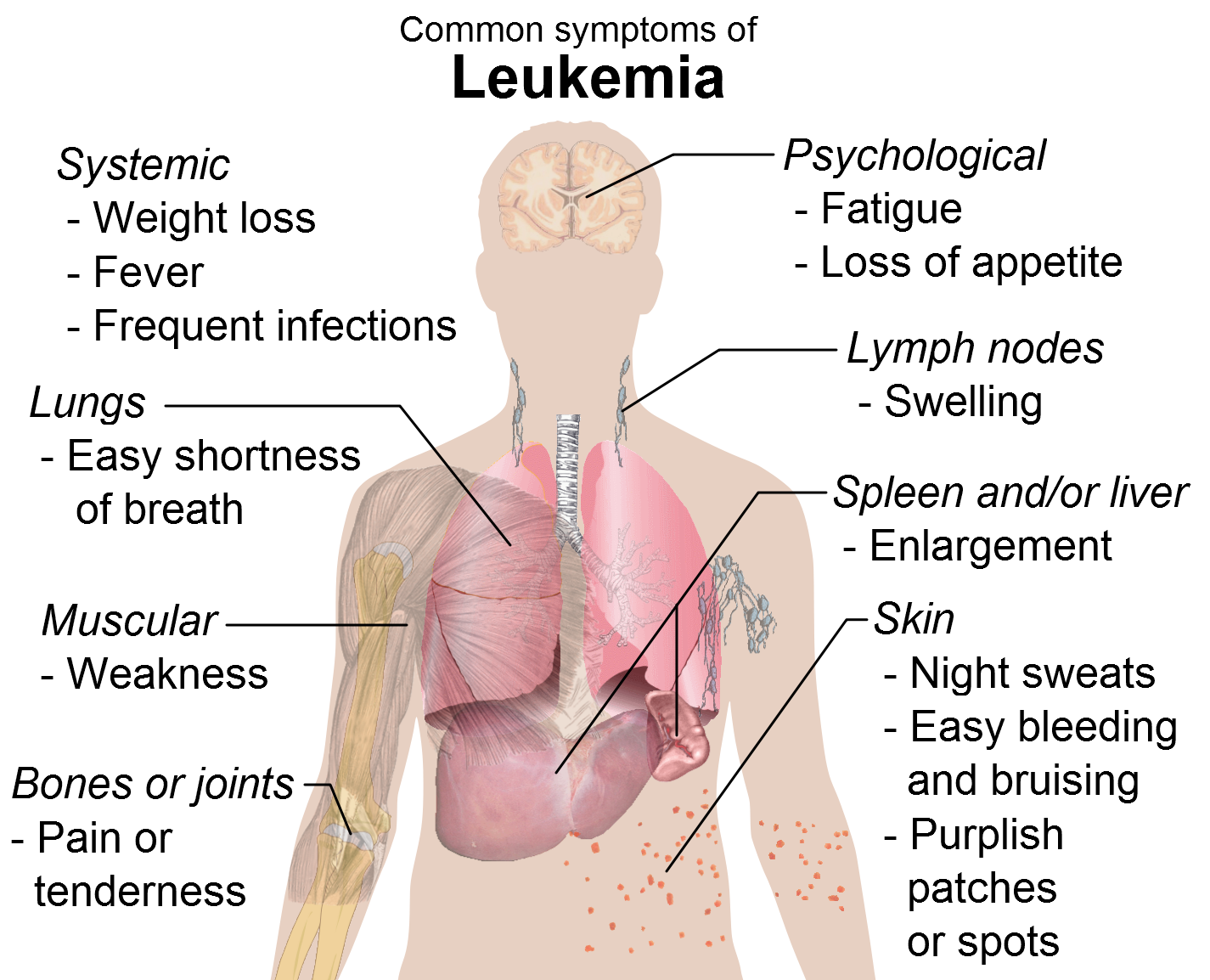
Η μυελοΐνωση είναι μία απειλητική για τη ζωή μορφή καρκίνου του αίματος που συσχετίζεται με προοδευτικά, εξουθενωτικά συμπτώματα που μπορούν να επηρεάσουν σοβαρά την ποιότητα ζωής και να βραχύνουν την επιβίωση
Σε μελέτες Φάσης III, το Jakavi μείωσε το μέγεθος του σπλήνα και τις εξουθενωτικές εκδηλώσεις της μυελοΐνωσης, στοχεύοντας στον υποκείμενο μηχανισμό της νόσου
Βασιλεία, 28 Αυγούστου, 2012 – Η Novartis έλαβε σήμερα έγκριση από την Ευρωπαϊκή Επιτροπή για το Jakavi® (INC424, ruxolitinib), έναν αναστολέα των JAK 1 και JAK 2 για την αντιμετώπιση της σχετιζόμενης με τη νόσο σπληνομεγαλίας ή συμπτωμάτων, σε ενήλικες ασθενείς με πρωτοπαθή μυελοΐνωση (επίσης γνωστή ως χρόνια ιδιοπαθής μυελοΐνωση), μυελοΐνωση μετά από αληθή πολυκυτταραιμία ή μυελοΐνωση μετά από ιδιοπαθή θρομβοκυττάρωση.
Η απόφαση της Ευρωπαϊκής Επιτροπής βασίστηκε σε θετικά ευρήματα από το πρόγραμμα κλινικής μελέτης COMFORT (Ελεγχόμενη μελέτη για τη μυελοΐνωση με από του στόματος θεραπεία με αναστολείς JAK).
«Η έγκριση του Jakavi από την Ευρωπαϊκή Επιτροπή φέρνει μία νέα θεραπευτική επιλογή που χρειάζεται επειγόντως και είναι πιθανό να κάνει μία πραγματική διαφορά στις ζωές των ασθενών», είπε ο Dr. Claire Harrison, MD, Guy’s and St. Thomas’ NHS Foundation Trust, Guy’s Hospital, London. «Στοχεύοντας στο απορυθμισμένο μονοπάτι των JAK, το Jakavi προσφέρει γρήγορο και διαρκές όφελος που έχει τη δυνατότητα να αποτελέσει ένα νέο πρότυπο θεραπείας».
Η μυελοΐνωση είναι ένας σπάνιος, απειλητικός για τη ζωή καρκίνος του αίματος που χαρακτηρίζεται από ανεπάρκεια του μυελού των οστών, διογκωμένο σπλήνα (σπληνομεγαλία), εξουθενωτικά συμπτώματα όπως ακραία κόπωση, νυχτερινή εφίδρωση και επίμονος κνησμός (φαγούρα), κακή ποιότητα ζωής και απώλεια σωματικού βάρους, καθώς και βραχύτερη επιβίωση.1 Στην Ε.Ε, η νόσος προσβάλλει περίπου 0,75 στους 100.000 ανθρώπους ετησίως.2,3 Η μυελοΐνωση εμφανίζεται όταν η ανεξέλεγκτη μεταγωγή σημάτων στο μονοπάτι των JAK – που ρυθμίζει την παραγωγή των κυττάρων του αίματος – προκαλεί ίνωση του μυελού των οστών και διαταραχή της παραγωγής των κυττάρων του αίματος, με αποτέλεσμα την αύξηση του μεγέθους του σπλήνα και άλλες σοβαρές επιπλοκές. Το Jakavi στοχεύει άμεσα τον υποκείμενο μηχανισμό της νόσου, μειώνοντας σημαντικά τη σπληνομεγαλία και βελτιώνοντας τα συμπτώματα ανεξάρτητα από την κατάσταση μετάλλαξης των JAK, τον υπότυπο της νόσου ή οποιαδήποτε προηγούμενη θεραπεία, περιλαμβανομένης της υδροξυουρίας.4,5
«Η έγκριση αυτή αποτελεί σημαντικό ορόσημο στην αντιμετώπιση θεραπευτικών αναγκών που δεν είχαν καλυφθεί για ασθενείς στην Ευρωπαϊκή Ένωση», είπε ο Hervé Hoppenot, Πρόεδρος της Novartis Oncology. «Έχουμε δεσμευτεί να αναπτύξουμε καινοτόμες θεραπείες για ορφανές νόσους και προωθούμε την έρευνα για να αξιολογήσουμε τις δυνατότητες της στοχευμένης θεραπείας με Jakavi σε άλλες κακοήθεις νόσους που σχετίζονται με το απορυθμισμένο μονοπάτι των JAK».
Η αποτελεσματικότητα και η ασφάλεια του Jakavi στην αντιμετώπιση ασθενών με μυελοΐνωση τεκμηριώθηκε σε κλινικές μελέτες, που περιελάμβαναν τις δύο πιλοτικές μελέτες Φάσης ΙΙΙ – τις COMFORT-I και COMFORT-II. Η χρόνια φλεγμονή μέσω αυξημένων επιπέδων κυτοκινών είναι μία από τις κύριες συνέπειες της απορύθμισης της μεταγωγής σημάτων των JAK 1 και JAK 2 και μπορεί να αποτελεί μείζονα συνιστώσα στη νοσηρότητα και στη θνητότητα των ασθενών με μυελοϋπερπλαστικές νεοπλασίες, όπως η μυελοΐνωση. Σε μία πιλοτική μελέτη Φάσης ΙΙΙ, το Jakavi αποδείχθηκε ότι αλλάζει την κλινική πορεία της μυελοΐνωσης αναστρέφοντας την εξέλιξη των συμπτωμάτων και τη σπληνομεγαλία, βελτιώνοντας έτσι την ποιότητα ζωής και επηρεάζοντας δυνητικά τη συνολική επιβίωση.4, 5
Η COMFORT-I έδειξε ότι 41,9% των ασθενών που αντιμετωπίστηκαν με το Jakavi πέτυχαν τουλάχιστον 35% μείωση (ισοδύναμη με περίπου 50% μείωση στο ψηλαφητό μέγεθος του σπλήνα) στον όγκο του σπλήνα σε 24 εβδομάδες από την έναρξη συγκριτικά με 0,7% των ασθενών στην ομάδα του εικονικού φαρμάκου (p<0,001). Μία πρώιμη ανάλυση των στοιχείων της COMFORT-I στις 51 εβδομάδες θεραπείας έδειξε ότι η θεραπεία με Jakavi είχε ως αποτέλεσμα ένα όφελος στη συνολική επιβίωση συγκριτικά με το εικονικό φάρμακο (αναλογία κινδύνου=0,50 [95% όριο αξιοπιστίας: 0,25, 0,98])5.
Τα συχνότερα αναφερόμενα ανεπιθύμητα συμβάντα βαθμού 3 ή υψηλότερου ήταν αιματολογικά. Ένας ασθενής σε κάθε ομάδα διέκοψε τη θεραπεία εξαιτίας θρομβοπενίας ή αναιμίας, αντίστοιχα. Τα πιο συχνά μη αιματολογικά ανεπιθύμητα συμβάντα οποιουδήποτε βαθμού που αναφέρθηκαν για ασθενείς που έλαβαν Jakavi ή εικονικό φάρμακο, αντίστοιχα, ήταν κόπωση (25% έναντι 34%), διάρροια (23% έναντι 21%), περιφερικό οίδημα (19% έναντι 22%) και εκχύμωση (19% έναντι 9%). Μία εβδομάδα μετά τη διακοπή του Jakavi, οι ασθενείς αυτοί παρουσίασαν επανεμφάνιση των συμπτωμάτων της μυελοΐνωσης που υπήρχαν πριν από την έναρξη της θεραπείας. Ωστόσο, όλα τα συμπτώματα που εμφάνισαν ως αποτέλεσμα της διακοπής της θεραπείας υποχώρησαν.5 Η COMFORT-I διεξήχθη στις Η.Π.Α. από την Incyte στα πλαίσια της παγκόσμιας συνεργασίας και της συμφωνίας εκχώρησης άδειας για το INC424 (ruxolitinib).
Στην COMFORT-II, το Jakavi οδήγησε σε μία ογκομετρική μείωση του μεγέθους του σπλήνα κατά 35% ή περισσότερο σε 28% των ασθενών σε σύγκριση με 0% των ασθενών στην ομάδα της καλύτερης διαθέσιμης θεραπείας (BAT) στις 48 εβδομάδες (p<0,001). Ως BAT ορίζεται κάθε εμπορικά διαθέσιμος παράγοντας (ως μονοθεραπεία ή σε συνδυασμό) ή η μη χορήγηση θεραπείας. Την εβδομάδα 24, 32% των ασθενών που αντιμετωπίστηκαν με Jakavi παρουσίασαν 35% ή μεγαλύτερη ογκομετρική μείωση του μεγέθους του σπλήνα συγκριτικά με 0% των ασθενών που αντιμετωπίστηκαν με BAT (p<0,001) για το βασικό δευτερεύον καταληκτικό σημείο. Επιπλέον, το Jakavi συσχετίστηκε με βελτιώσεις στα συμπτώματα της μυελοΐνωσης σε κάθε αξιολόγηση σε σύγκριση με την ομάδα της BAT. Το Jakavi επέδειξε μέτρια τοξικότητα συγκριτικά με την BAT, με αυξημένη συχνότητα αναιμίας και θρομβοπενίας. Το συχνότερα αναφερόμενο σοβαρό ανεπιθύμητο συμβάν (SAE) ήταν η αναιμία και στις δύο ομάδες (INC424, 5%, BAT, 4%). Η πνευμονία ήταν το μόνο SAE που αναφέρθηκε σε ≥5% των ασθενών σε κάθε μία από τις ομάδες (INC424, 1%; BAT, 5%).4 Τα ευρήματα αυτά είναι σε συμφωνία με την προηγηθείσα έρευνα για το INC424.7
Η συνεχής θεραπεία με Jakavi επέφερε επίσης μία αξιοσημείωτη και διατηρούμενη βελτίωση στους συνολικούς δείκτες της ποιότητας ζωής, στη λειτουργικότητα και στα συμπτώματα, περιλαμβανομένης της απώλειας όρεξης, της δύσπνοιας (λαχάνιασμα), της κόπωσης, της αϋπνίας και του άλγους, την εβδομάδα 48, σε σύγκριση με μία επιδείνωση των συμπτωμάτων στους ασθενείς που αντιμετωπίστηκαν με BAT. Το Jakavi επέδειξε μέτρια τοξικότητα συγκριτικά με την BAT, με αυξημένη συχνότητα αναιμίας και θρομβοπενίας. Το πιο συχνά αναφερόμενο SAE για το Jakavi ήταν η αναιμία και για τις δύο ομάδες (5%). Πνευμονία αναφέρθηκε στο 1% των ασθενών που έλαβαν Jakavi4.
Σχετικά με τη Μυελοΐνωση
Η μυελοΐνωση είναι μία απειλητική για τη ζωή μορφή καρκίνου του αίματος με κακή πρόγνωση και περιορισμένες θεραπευτικές επιλογές.1,7 Οι μελέτες δείχνουν ότι οι ασθενείς με μυελοΐνωση έχουν χαμηλό προσδόκιμο επιβίωσης, με διάμεση επιβίωση τα 5,7 έτη.8 Παρότι η αλλογενής μεταμόσχευση αρχέγονων κυττάρων μπορεί να θεραπεύσει τη μυελοΐνωση, η διαδικασία συσχετίζεται με σημαντική νοσηρότητα και θνητότητα και είναι διαθέσιμη σε λιγότερο από το 5% των ασθενών, οι οποίοι είναι νέοι και σε αρκετά καλή σωματική κατάσταση για να υποβληθούν στη διαδικασία.9
Σχετικά με το Jakavi
Το Jakavi® (INC424, ruxolitinib) είναι ένα από του στόματος αναστολέας των τυροσινικών κινασών JAK 1 και JAK 2.4 Η συνιστώμενη αρχική δόση για το Jakavi είναι 15 mg δύο φορές την ημέρα για ασθενείς με αριθμό αιμοπεταλίων μεταξύ 100.000 ανά κυβικό χιλιοστόμετρο (mm3)και 200.000/mm3 και 20 mg δύο φορές την ημέρα για ασθενείς με αριθμό αιμοπεταλίων >200.000/mm3. Οι δόσεις θα πρέπει να τιτλοποιηθούν σύμφωνα με την ασφάλεια και την αποτελεσματικότητα.
Η Novartis έλαβε άδεια για το INC424 (ruxolitinib) από την Incyte για την ανάπτυξη και την ενδεχόμενη εμπορική κυκλοφορία εκτός των Η.Π.Α. Η Incyte διατήρησε τα δικαιώματα για την ανάπτυξη και την εμπορική κυκλοφορία του INC424 (ruxolitinib) στις Η.Π.Α. Τόσο η Ευρωπαϊκή Επιτροπή όσο και ο Οργανισμός Τροφίμων και Φαρμάκων των Η.Π.Α. (FDA) απέδωσαν στο INC424 (ruxolitinib) κατάσταση ορφανού φαρμάκου για τη μυελοΐνωση. Η Incyte έλαβε την έγκριση του FDA για το INC424 (ruxolitinib) το Νοέμβριο του 2011 υπό την ονομασία Jakafi® για την αντιμετώπιση ασθενών με μυελοΐνωση ενδιάμεσου ή υψηλού κινδύνου.
Στα πλαίσια του προγράμματος κλινικής ανάπτυξης της Novartis, το Jakavi ερευνάται επίσης σε κλινικές μελέτες για την αντιμετώπιση της αληθούς πολυκυτταραιμίας.10
Το Jakavi αποτελεί κατοχυρωμένο εμπορικό σήμα της Novartis AG σε χώρες εκτός των Ηνωμένων Πολιτειών.
Σημαντικές Πληροφορίες Ασφάλειας για το Jakavi®
Το Jakavi® μπορεί να προκαλέσει σοβαρές ανεπιθύμητες ενέργειες, που περιλαμβάνουν μείωση του αριθμού των κυττάρων του αίματος και λοιμώξεις. Συνιστάται πλήρης παρακολούθηση της αιματολογικής εικόνας. Μπορεί να χρειαστεί μείωση ή διακοπή της δόσης σε ασθενείς με σοβαρή ηπατική ή νεφρική δυσλειτουργία ή σε ασθενείς που αναπτύσσουν αιματολογικές ανεπιθύμητες ενέργειες, όπως θρομβοπενία, αναιμία και ουδετεροπενία. Μειώσεις της δόσης συνιστώνται επίσης όταν το Jakavi συγχορηγείται με ισχυρούς αναστολείς του CYP3A4 ή με φλουκοναζόλη. Η χρήση του Jakavi στη διάρκεια της κύησης δεν συνιστάται και οι γυναίκες θα πρέπει να αποφεύγουν την εγκυμοσύνη στη διάρκεια της θεραπείας με Jakavi. Οι γυναίκες που λαμβάνουν Jakavi δεν θα πρέπει να θηλάζουν.
Οι συχνότερες ανεπιθύμητες ενέργειες του φαρμάκου (επίπτωση >10%) είναι ουρολοιμώξεις, αναιμία, θρομβοπενία, ουδετεροπενία, υπερχοληστερολαιμία, ζάλη, κεφαλαλγία, αύξηση της αλανινικής αμινοτρανσφεράσης, αύξηση της ασπαρτικής αμινοτρανσφεράσης, μωλωπισμός, αιμορραγία και αυξημένη αρτηριακή πίεση. Άλλες συχνές ανεπιθύμητες ενέργειες του φαρμάκου (επίπτωση 1 έως 10%) είναι έρπητας ζωστήρας, πρόσληψη σωματικού βάρους, μετεωρισμός και φυματίωση.
Δήλωση αποποίησης ευθύνης
Η ανωτέρω δημοσίευση περιλαμβάνει φράσεις σχετικά με μελλοντικές εξελίξεις, οι οποίες μπορούν να αναγνωριστούν με ορολογία όπως «πιθανός», «δεσμευμένος» «δυνητικά», «ερευνάται» ή παρόμοιες εκφράσεις ή με ρητές ή έμμεσες διατυπώσεις όσον αφορά ενδεχόμενες επιπρόσθετες εγκρίσεις εμπορικής κυκλοφορίας για το Jakavi ή αναφορικά με την ενδεχόμενη έγκριση νέων ενδείξεων ή επισήμανσης για το Jakavi, και το χρόνο τέτοιων εγκρίσεων ή όσον αφορά ενδεχόμενα μελλοντικά έσοδα από το Jakavi. Δεν θα πρέπει να βασίζεστε υπέρμετρα σε αυτές τις δηλώσεις. Αυτού του τύπου οι φράσεις σχετικά με μελλοντικές εξελίξεις εκφράζουν την τρέχουσα άποψη της διοίκησης σχετικά με μελλοντικά συμβάντα και εμπεριέχουν γνωστούς και άγνωστους κινδύνους, αβεβαιότητες και άλλους παράγοντες, εξαιτίας των οποίων τα πραγματικά αποτελέσματα για το Jakavi ενδέχεται να είναι ουσιωδώς διαφορετικά από οποιαδήποτε μελλοντικά αποτελέσματα, επιδόσεις ή επιτεύγματα που αναφέρονται ρητώς ή εμμέσως μέσω αυτού του τύπου φράσεων. Δεν μπορεί να υπάρξει εγγύηση ότι το Jakavi θα εγκριθεί για πώληση σε οποιαδήποτε επιπλέον αγορά ή για οποιεσδήποτε πρόσθετες ενδείξεις ή επισήμανση ή σε οποιαδήποτε συγκεκριμένη χρονική στιγμή. Ούτε μπορεί να υπάρξει κάποια εγγύηση ότι το Jakavi θα επιτύχει οποιαδήποτε συγκεκριμένα επίπεδα εσόδων στο μέλλον. Συγκεκριμένα, οι προσδοκίες της διοίκησης όσον αφορά το Jakavi, θα μπορούσαν να επηρεαστούν, μεταξύ άλλων, από απροσδόκητες ενέργειες ή καθυστερήσεις των ρυθμιστικών αρχών ή από κρατικές ρυθμίσεις γενικότερα, μη αναμενόμενα αποτελέσματα κλινικών δοκιμών συμπεριλαμβανομένων νέων μη αναμενόμενων κλινικών δεδομένων και της μη αναμενόμενης περεταίρω ανάλυσης των υπαρχόντων κλινικών δεδομένων, από τον ανταγωνισμό γενικά, τις πιέσεις από το κράτος, τον κλάδο και το ευρύ κοινό σχετικά με την κοστολόγηση, από μη αναμενόμενα θέματα που αφορούν την παρασκευή, από τη δυνατότητα της εταιρείας να λάβει ή να διατηρήσει δικαιώματα ευρεσιτεχνίας ή άλλης προστασίας πνευματικής ιδιοκτησίας, από την επίδραση που θα μπορούσαν να έχουν οι παραπάνω παράγοντες στις αξίες που αποδίδονται στα στοιχεία του ενεργητικού και του παθητικού του Ομίλου Novartis, όπως καταγράφονται στον ενοποιημένο ισολογισμό του Ομίλου, καθώς και από άλλους παράγοντες που αναλύονται στο Έντυπο 20-F της Novartis AG, το οποίο έχει κατατεθεί στην Επιτροπή Κεφαλαιαγοράς των Η.Π.Α. Εάν ένας ή περισσότεροι από αυτούς τους κινδύνους ή τις αβεβαιότητες τελικά πραγματωθεί ή εάν οι υφιστάμενες παραδοχές αποδειχθούν εσφαλμένες, τα πραγματικά αποτελέσματα ενδέχεται να διαφέρουν ουσιωδώς από τα προσδοκώμενα, θεωρούμενα, εκτιμώμενα ή αναμενόμενα αποτελέσματα. Η Novartis παρέχει στο παρόν Δελτίο Τύπου τις πληροφορίες που διαθέτει μέχρι αυτή τη στιγμή και δεν αναλαμβάνει οποιαδήποτε υποχρέωση για επικαιροποίηση των φράσεων περί μελλοντικών εξελίξεων οι οποίες περιέχονται στο παρόν Δελτίο Τύπου ως αποτέλεσμα νέων πληροφοριών, μελλοντικών συμβάντων ή για οποιοδήποτε άλλο λόγο.
Σχετικά με τη Novartis
Η Novartis παρέχει καινοτόμες λύσεις για τη φροντίδα της υγείας, οι οποίες αντιμετωπίζουν τις αυξανόμενες ανάγκες των ασθενών και των κοινωνιών. Με έδρα στη Βασιλεία της Ελβετίας, η Novartis παρέχει ένα ποικιλόμορφο χαρτοφυλάκιο, ώστε να ανταποκρίνεται καλύτερα σε αυτές τις ανάγκες: καινοτόμα φάρμακα, φροντίδα των οφθαλμών, οικονομικά γενόσημα φαρμακευτικά προϊόντα, προληπτικά εμβόλια και διαγνωστικά εργαλεία, μη συνταγογραφούμενα προϊόντα και προϊόντα υγείας των ζώων. Η Novartis είναι η μόνη εταιρεία παγκοσμίως που κατέχει ηγετική θέση σε αυτά τα πεδία. Το 2011, ο Όμιλος είχε καθαρές πωλήσεις ύψους 58,6 δις αμερικανικών δολαρίων, ενώ περίπου 9,6 δις αμερικανικά δολάρια (9,2 δις αμερικανικά δολάρια με εξαίρεση τα έξοδα απομειώσεων και αποσβέσεων) επενδύθηκαν σε δραστηριότητες έρευνας και ανάπτυξης σε όλο τον Όμιλο. Οι εταιρείες του Ομίλου Novartis απασχολούν περίπου 126.000 εργαζόμενους πλήρους απασχόλησης και δραστηριοποιούνται σε περισσότερες από 140 χώρες του κόσμου. Για περισσότερες πληροφορίες, παρακαλούμε επισκεφθείτε τον ιστότοπο http://www.novartis.com.
Η Novartis είναι στο Twitter. Εγγραφείτε για να παρακολουθείτε τη Novartis στο http://twitter.com/novartis.
Βιβλιογραφία
1. Mesa RA, Schwagera S, Radia D, et al. The Myelofibrosis Symptom Assessment Form (MFSAF): an evidence-based brief inventory to measure quality of life and symptomatic response to treatment in myelofibrosis. Leuk Res. 2009;33:1199-1203.
2. Girodon F, Bonicelli G, Schaeffer C, et al. Significant increase in the apparent incidence of essential thrombocythemia related to new WHO diagnostic criteria: a population-based study. Haematologica. 2009; 94(6):865-869.
3. McNally RJQ, Rowland D, Roman E, Cartwright RA. Age and sex distributions of hematological malignancies in the U.K. Hematol Oncol. 1997;15:173–189.
4. Harrison C, Kiladjian JJ, Al-Ali HK, et al. JAK Inhibition with Ruxolitinib versus Best Available Therapy for Myelofibrosis. New Eng J Med. 2012: March 1;366:787-98.
5. Verstovsek S, Mesa RA, Gotlib J, et al. A Double-Blind, Placebo-Controlled Trial of Ruxolitinib for Myelofibrosis. New Eng J Med. 2012: March 1;366:799-807.
6. Hasselbach, H. Perspectives on chronic inflammation in essential thrombocythemia, polycythemia vera, and myelofibrosis. Blood. 2012. Epub ahead of print February 7.
7. Verstovsek S, Kantarjian H, Mesa RA, et al. Safety and Efficacy of JAK1 & JAK2 Inhibitor, INCB018424, in Myelofibrosis. New Eng J Med. 2010 September 16;363:1117-1127.
8. Cervantes F, Dupriez B, Pereira A, et al. New prognostic scoring system for primary myelofibrosis based on a study of the International Working Group for Myelofibrosis Research and Treatment. Blood. 2009;113:2895–2901.
9. Patriarca F, Bacigalupo A, Sperotto A, et al. Allogeneic hematopoietic stem cell transplantation in myelofibrosis: the 20-year experience of the Gruppo Italiano Trapianto di Midollo Osseo (GITMO). Haematologica. 2008;93(10):1514-1522.
10. National Institutes of Health. Study of Efficacy and Safety in Polycythemia Vera Subjects Who Are Resistant to or Intolerant of Hydroxyurea: JAK Inhibitor JAKAVI (INCB018424) Tablets Versus Best Available Care: The RESPONSE Trial. Available at http://www.clinicaltrials.gov/ct2/show/NCT01243944?term=ruxolitinib&rank=14. Accessed January 31, 2012.
# # #
Τμήμα Σχέσεων με τα ΜΜΕ της Novartis
| Κεντρική τηλεφωνική γραμμή επικοινωνίας με τα ΜΜΕ: +41 61 324 2200 | |
|
Eric AlthoffΠαγκόσμιο Τμήμα Σχέσεων με τα ΜΜΕ της Novartis +41 61 324 7999 (απευθείας) +41 79 593 4202 (κινητό) |
Amy VinciΔιεύθυνση Ογκολογίας Novartis +1 862 778 6309 (απευθείας) +1.917.535 2602 (κινητό) amy.vinci@novartis.com |
e-mail: media.relations@novartis.com
Για περιεχόμενο πολυμέσων της Novartis, παρακαλούμε επισκεφθείτε τον ιστότοπο www.thenewsmarket.com/Novartis
Για ερωτήσεις σχετικά με τον ιστότοπο ή την απαιτούμενη εγγραφή, παρακαλούμε απευθυνθείτε στο: journalisthelp@thenewsmarket.com
Τμήμα Επενδυτικών Σχέσεων της Novartis
| Κεντρική τηλεφωνική γραμμή: | +41 61 324 7944 | ||
| Susanne Schaffert | +41 61 324 7944 | Βόρεια Αμερική: | |
| Pierre-Michel Bringer | +41 61 324 1065 | Helen Boudreau | +1 212 830 2404 |
| Thomas Hungerbuehler | +41 61 324 8425 | Jill Pozarek | +1 212 830 2445 |
| Isabella Zinck | +41 61 324 7188 | Edwin Valeriano | +1 212 830 2456 |
| e-mail: investor.relations@novartis.com | e-mail: investor.relations@novartis.com | ||