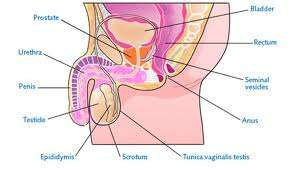
Καρκίνος όρχεως
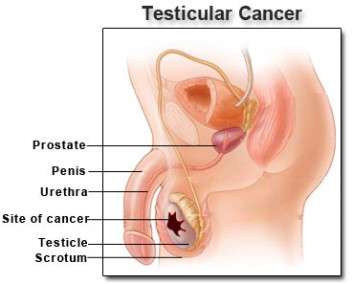
Ο καρκίνος του όρχεως είναι σπάνιος (η συχνότητα εμφάνισης είναι <1% όλων των όγκων), αλλά αντιπροσωπεύει μία από τις συχνότερες κακοήθειες που εμφανίζονται στους νέους άνδρες. Θεραπεύεται σε μεγάλο ποσοστό και η διάρκεια της ζωής αυτών των ασθενών είναι πολύ μακρά. Απαιτείται μακροχρόνιο follow up στους θεραπευμένους ασθενείς.
ΚΛΙΝΙΚΕΣ ΕΚΔΗΛΩΣΕΙΣ
Επιδημιολογία: Για το 2000, 6.900 νέες περιπτώσεις και 300 θάνατοι εμφανίσθησαν στις ΗΠΑ. Αποτελεί το 1% όλων των κακοηθειών στους άνδρες. Η μεγαλύτερη συχνότητα εμφανίζεται μεταξύ της ηλικίας των 20 – 35 ετών. Παράγοντες κινδύνου: Η κρυψορχία (κυρίως όταν ο όρχις έχει παραμείνει στην κοιλιακή χώρα). Το σύνδρομο Klinefelter (ηυξημένος κίνδυνος εμφάνισης όγκων από γεννητικά κύττταρα στο μεσοθωράκιο).
ΔΙΑΓΝΩΣΗ
Οποιαδήποτε μάζα στους όρχεις στους άντρες θα πρέπει να εξετάζεται ώστε να αποκλειστεί η ύπαρξη καρκίνου όρχεως. Ο καρκίνος του όρχεως είναι ιάσιμος σε υψηλά ποσοστά (85% των περιπτώσεων). Η ιστολογική εξακρίβωση του τύπου του όγκου έχει προγνωστική και θεραπευτική σημασία. Διαγνωστική προσέγγιση: Σε εμφάνιση ογκιδίου στον όρχι, ο ασθενής υποβάλλεται σε αμφοτερόπλευρο υπερηχογράφημα όρχεων. Επί εμφάνισης καλοήθους όζου, ο ασθενής απλά παρακολουθείται. Επί ύπαρξης ύποπτης μάζας υποβάλλεται στις εξετάσεις: LDH, β-HCG, AFP και σε διαγνωστική ορχεκτομή. Επί εμφάνισης καλοήθειας απαιτείται απλή παρακολούθηση.
Εργαστηριακές Εξετάσεις
Serum α-fetoprotein (AFP): Ο βιολογικός χρόνος της ημισείας ζωής είναι περίπου 5 – 7 μέρες. Συνήθως, εκκρίνεται από τα καρκινικά κύτταρα εμβρυογενούς προέλευσης. Δεν εκκρίνεται από τα αμιγώς καθαρά σεμινώματα και η ανίχνευσή της καθορίζει την ύπαρξη μη σεμινωματώδους όγκου. Serum β-ΗCG: O χρόνος της ημισείας ζωής της είναι περίπου 24 ώρες. Μπορεί βιολογικά να είναι δραστήρια οδηγώντας σε αναστολή της παραγωγής οιστρογόνων από τους όρχεις και σε εμφάνιση γυναικομαστίας. Εκκρίνεται από τα συγκιοτροφοβλαστικά γιγαντοκύτταρα. Είναι παρούσα στα χοριοκαρκινώματα. Serum LDH: Χρησιμεύει σαν προγνωστικός δείκτης. Αντανακλά στον πολλαπλασιασμό ή στην σμίκρυνση του όγκου.
ΠΙΝΑΚΑΣ 1. Όγκοι από γεννητικά κύτταρα και ιστοπαθολογικά χαρακτηριστικά τους
ΤΥΠΟΣ ΟΓΚΟΥ
ΠΑΘΟΛΟΓΟΑΝΑΤΟΜΙΚΟ ΥΠΟΣΤΡΩΜΑ
Όγκοι από γεννητικά κύτταρα
Σεμινώματα (40 – 50%)
Μονήρεις όγκοι (60%)
Μικτοί όγκοι (40%)
Μη σεμινώματα (50 – 60%)
Όγκοι από εμβρυϊκά κύτταρα
Ογκοι Yolk sac
Τερατώματα
Χοριοκαρκινώματα
Όγκοι από γοναδικό στρώμα (1 – 2%)
Κύτταρα Leydig
Κύτταρα Sertoil
Γοναδοβλάστωμα
Γεννητικά κύτταρα + στρωματικά κύτταρα
Η PLAP (πλακουντιακή αλκαλική φωσφατάση) είναι θετική σε ενδιάμεσους όγκους αμφιβόλου ιστογένεσης. Αρνητική για χαμηλού μοριακού βάρους κερατίνες ανοσοιστοχημικά, εμφανίζονται στα σεμινώματα. Όγκοι οι οποίοι εκφράζουν χαμηλού μοριακού βάρους κερατίνες συνήθως είναι εμβρυϊκά καρκινώματα. Όγκοι από γεννητικά κύτταρα συνήθως είναι υπερπλοιδικοί. Η απώλεια του ετεροζυγώτη συχνά απεδείχθει σε πρώιμα στάδια της νόσου και δεν σχετίζεται με την πρόοδο της νόσου. 80% των περιπτώσεων έχουν ένα ισο-χρωμόσωμα στο βραχύ σκέλος του χρωμοσώματος 12[i(12p)], εμπλέκοντας ένα ή περισσότερα γονίδια στο 12p ή στην κακοήθη εξαλλαγή των γεννητικών κυττάρων.
ΠΡΟΓΝΩΣΗ
ΠΙΝΑΚΑΣ 2. Διεθνής συναίνεση και κατηγοριοποίηση της πρόγνωσης των όγκων από γεννητικά κύτταρα
ΠΡΟΓΝΩΣΗ
ΜΗ ΣΕΜΙΝΩΜΑΤΩΔΕΙΣ
ΣΕΜΙΝΩΜΑΤΩΔΕΙΣ
Καλή
Ύπαρξη όγκου στον όρχι ή οπισθοπεριτοναϊκώς και μη ύπαρξη πνευμονικών ή σπλαχνικών μεταστάσεων
AFP < 1.000 μg/mL
HCG < 5.000 IU/L
LDH < 1,5 των φυσιολογικών τιμών
Ύπαρξη όγκου σε οποιοδήποτε μέρος και μη ύπαρξη πνευμονικών ή σπλαχνικών μεταστάσεων
AFP < 1.000 μg/mL
Οποιαδήποτε τιμή HCG και LDH
Ενδιάμεση
Ύπαρξη όγκου στον όρχι ή οπισθοπεριτοναϊκώς και μη ύπαρξη πνευμονικών ή σπλαχνικών μεταστάσεων
AFP ³ 1.000 μg/mL
HCG ³ 5.000 IU/L
LDH ³ 1,5 των φυσιολογικών τιμών
Ύπαρξη όγκου σε οποιοδήποτε μέρος και μη ύπαρξη πνευμονικών ή σπλαχνικών μεταστάσεων
AFP < 1.000 μg/mL
Οποιαδήποτε τιμή HCG και LDH
Κακή
Ύπαρξη όγκου στο μεσοθωράκιο πρωτοπαθώς και μη ύπαρξη πνευμονικών ή σπλαχνικών μεταστάσεων
AFP > 10.000 μg/mL
HCG > 50.000 IU/L (10.000 μg/mL) ή
> 10 x από τα φυσιολογικά όρια
Κανείς άρρωστος δεν ταξινομείται ως κακής πρόγνωσης
ΘΕΡΑΠΕΙΑ
Θεραπευτική προσέγγιση αναφορικά με το στάδιο και τον ιστολογικό τύπο
AJCC Στάδιο Ι (Τ1-4, Ν0, Μ0, S0-3): Οι ασθενείς με σεμίνωμα υποβάλλονται σε ορχεκτομή και παρακολούθηση – follow up (κλινική αξιολόγηση, εργαστηριακός έλεγχος και αξονικές τομογραφίες) κάθε 2μηνο τον πρώτο χρόνο, κάθε 3μηνο τον δεύτερο χρόνο, κάθε 4μηνο τον τρίτο χρόνο, κάθε 6μηνο τον τέταρτο χρόνο και ακολούθως κάθε χρόνο.
Σε ασθενείς με μη σεμίνωμα θετικούς λεμφαδένες και παθολογοανατομικό στάδιο ΙΙ θα λάβουν 2 κύκλους χημειοθεραπείας με το σχήμα BEP. Αυτοί που έχουν αρνητικούς λεμφαδένες παθολογοανατομικού σταδίου Ι απαιτείται απλή παρακολούθηση κάθε 2μηνο τον πρώτο και δεύτερο χρόνο, κάθε 3μηνο τον τρίτο και τέταρτο χρόνο,
κάθε 6μηνο τον πέμπτο χρόνο και ακολούθως κάθε χρόνο.
AJCC Στάδια ΙΙ – ΙΙΙ (Τ1-4, Ν1-3, Μ0, S0-3) χωρίς μεταστάσεις: Σε ασθενείς με σεμίνωμα με φορτίο νόσου από την αξονική τομογραφία 5cm θα πάρουν 4 κύκλους EP ή 3 κύκλους BEP και ακολούθως απαιτείται παρακολούθηση κάθε 2μηνο τον πρώτο χρόνο, κάθε 3μηνο τον δεύτερο χρόνο, κάθε 4μηνο τον τρίτο χρόνο, κάθε 6μηνο τον τέταρτο χρόνο και ακολούθως κάθε χρόνο.
Σε ασθενείς με μη σεμίνωμα, Αυτοί που έχουν >6 θετικούς λεμφαδένες ή θετικούς νεοπλασματικούς δείκτες θα πάρουν θεραπεία 4 κύκλους ΕΡ ή 3 κύκλους ΒΕΡ.
Εάν μετά την θεραπεία δεν υπάρχει υπολειμματική νόσος και οι νεοπλασματικοί δείκτες είναι αρνητικοί απαιτείται παρακολούθηση ως ανωτέρω. Εάν οι νεοπλασματικοί δείκτες είναι θετικοί θα λάβουν επιπλέον 2 κύκλους ΒΕΡ.
Σε αυτούς τους ασθενείς που μετά τους 3 πρώτους κύκλους ΒΕΡ έχουν ακόμη υπολειμματική νόσο απαιτείται χειρουργική αφαίρεση και εφόσον η ιστολογική δείξει κακοήθεια θα πάρουν άλλους 2 κύκλους ΒΕΡ. ΑJCC Στάδιο ΙΙΙ (Τ1-4, Ν1-3, Μ1, S0-3) με απομακρυσμένες μεταστάσεις: Όλοι αυτοί οι ασθενείς (με σεμίνωμα ή μη σεμίνωμα) θα υποστούν ορχεκτομή εφόσον είναι χαμηλού κινδύνου θα λάβουν 4 κύκλους ΕΡ ή 3 κύκλους ΒΕΡ. Εάν είναι υψηλού κινδύνου θα λάβουν 4 κύκλους ΒΕΡ. Ακολούθως, εφόσον οι νεοπλασματικοί δείκτες είναι θετικοί μπορεί να αξιολογηθούν οι ασθενείς στο να λάβουν ακτινοθεραπεία (σεμινώματα) ή θεραπεία συντήρησης με 2 κύκλους ΒΕΡ ή θεραπεία διάσωσης με 4 κύκλους VIP. Επί αρνητικών νεοπλασματικών δεικτών εφόσον υπάρχει υπολειπόμενη νόσος οι ασθενείς χειρουργούνται και εφόσον υπάρχει κακοήθεια λαμβάνουν την ανωτέρω θεραπεία. Εάν δεν υπάρχει υπολειπόμενη νόσος ή το χειρουργείο δείξει καλοήθη μάζα τότε οι ασθενείς παρακολουθούνται, κλινικά και εργαστηριακά, κάθε 2μηνο τον πρώτο χρόνο, κάθε 3μήνο τον δεύτερο χρόνο, κάθε 4μηνο τον τρίτο χρόνο, κάθε 6μηνο τον τέταρτο χρόνο και ακολούθως κάθε χρόνο.
Πίνακας 3. Συνήθη χρησιμοποιούμενα σχήματα
Σχήμα
EP
Etoposide: 100 mg/m2/d x 5 μέρες
CDDP: 20 mg/m2/d x 5 μέρες
4 κύκλοι σε διάστημα 3 εβδομάδων
BEP
Bleomycin: 30 U IV εβδομάδες d1, d9, d16
Etoposide: 100 mg/m2/d d1-d5
CDDP: 20 mg/m2/d d1-d5
2 – 4 κύκλοι σε διάστημα 3 εβδομάδων
VIP
Vinblastine: 0,11 mg/kg εβδομάδα 1 – 2
Ιfosfamide: 1,20 g/m2 IV/d d1-d5
Mesna: 400 mgr/m2 IV ανά 8ωρο d1-d5
CDDP: 20 mgr/m2 IV/d d1-d5
3 – 4 κύκλοι σε διάστημα 3 εβδομάδων
PVB
CDDP: 20 mgr/m2 IV/d d1-d5
Vinblastine: 0,11 mg/kg ΙV/d d1-d5
Bleomycin: 30 U IV d2, d9, d16
3 κύκλοι σε διάστημα 3 εβδομάδων
Στο σεμίνωμα (για όλα τα στάδια), η θεραπευτική προσέγγιση έγγειται στο 90%. Όγκοι με μεικτά στοιχεία (σεμινωματώδη και μη) αντιμετωπίζονται ως μη σεμίνωμα. Σεμινώματα με υψηλή τιμή AFP αντιμετωπίζονται ως μη σεμίνωμα. Ασθενείς με εγκεφαλικές μεταστάσεις πρέπει να λαμβάνουν ακτινοθεραπεία εγκεφάλου μαζί με χημειοθεραπεία. Μία μεγάλη τυχαιοποιημένη μελέτη έδειξε παρόμοια συνολική επιβίωση και ελεύθερο νόσου διάστημα για την χημειοθεραπεία με τα σχήματα BEP (bleomycin, etoposide, cisplatin) έναντι PVB (cisplatin, viblastine, bleomycin), και έναντι VIP (viblastine, ifosfamide, cisplatin). 4 κύκλοι BEP είναι ισοδύναμοι με 3 κύκλους BEP.
Τοξικότητα οφειλομένη στην χημειοθεραπεία
Στείρωση: Όλοι οι ασθενείς γίνονται ολιγοσπερμικοί κατά την θεραπεία και θα πρέπει να συστήνεται να φυλάσσουν το σπέρμα τους σε τράπεζα σπέρματος πριν την θεραπεία. Πνευμονική τοξικότητα: Σχετίζεται με την bleomycin, σπανίως θανατηφόρα σε συνολική αθροιστική δόση £ 400 μονάδων. Νεφροτοξικότητα: Μπορεί να εμφανιστεί σε σχήματα με βάση την πλατίνα. Νευροτοξικότητα και διαταραχές της ακοής: Σε σχήματα με βάση την πλατίνα. Καρδιαγγειακές επιπλοκές: Υπέρταση, φαινόμενο Raynaud, υπερχοληστεριναιμία. Δευτεροπαθείς κακοήθειες: Σε παρατεταμένη έκθεση σε αλκυλιούντες παράγοντες, ετοποσίδη, και στην χρήση ακτινοθεραπείας. Δευτεροπαθείς λευχαιμίες: Από την χρήση ετοποσίδης. Χαρακτηρίζεται από μετάθεση του χρωμοσώματος 11-q23 και συνήθως εμφανίζεται αρκετά χρόνια μετά την θεραπεία. Καρκίνοι στομάχου, ουροδόχου κύστεως και παγκρέατος: Σχετίζονται με έκθεση σε ακτινοβολία (σεμινωματώδεις όγκοι), περιορίζονται στο πεδίο της ακτινοθεραπείας και εμφανίζονται πολύ αργότερα μέσα σε μία δεκαετία και πλέον.
ΠΡΟΤΕΙΝΟΜΕΝΗ ΒΙΒΛΙΟΓΡΑΦΙΑ
1. Kenneth Pienta, Howard Sandler, Timothy Wilson et al.: In prostate cancer (chapter-19-in cancer management-a multidisciplinary approach). Edited by R. Pazdur, L. Coia, W. Hoskins, and L. Wagman, 1998, pp. 395 – 415.
2. Rogers E, Ohori M, Kaddabian VS, et al. Salvage radical prostatectomy: Outcome measured by serum prostate specific antigen levels. J Urol 153: 104, 1995. PSA levels after salvage radical prostatectomy.
3. Bubley GJ, Carducci M, Dahut W, et al. Eligibility and response guidelines for phase II clinical trials in androgen-independent prostate cancer: recommendations from the prostate-specific antigen working group. J Clin Oncol 1999; 17:3461 – 3467.
4. Oh WK, Kantoff PW: Management of hormone refractory prostate cancer: current standards and future prospects. J Urol 1998; 160:1220 – 1229.
5. Tannock I, Gospodarowicz M, Meakin W, et al. Treatment of metastatic prostatic cancer with low-dose prednisone: evaluation of pain and quality of life as pragmatic indices of response. J Clin Oncol 1989;7:590 – 597.
6. Petrylac DP, Macarthur RB, O’Connor J, et al. Phase I trial of docetaxel with estramustine in androgen-independent prostate cancer. J Clin Oncol 1999; 17:958 – 967.
7. Pienta KJ, Redman B, Hussein M, et al.: Phase II evaluation of oral estramustine and oral etoposide in hormone-refactory adenocarcinoma of the prostate J Clin Oncol 1994; 12:2005.
8. Tannock IF, Osada D, Stockler MR, et al.: Chemotherapy with mitoxantrone plus prednisone or prednisone alone for symptomatic hormone-resistant prostate cancer: a Canadian randomized trial with palliative end points. J Clin Oncol 1996; 14:1756 - 1764.
9. Einhorn LH, Donohue JP. Advanced testicular cancer: update for urologists. J Urol 1998; 160: 1964 – 1969.
10. Travis LB, Curtis RE, Storm H, et al. Risk of second malignant neoplasms among long-term survivors of testicular cancer. J Natl Cancer Inst 1997; 89:1429 – 1439.
11. Einhorn LH. Testicular cancer: an oncological success story. Clin Cancer Res 1997; 3:2360 – 2632.