Γαστρεντερικοί στρωματικοί όγκοι: χειρουργείο και σύγχρονες εξελίξεις στη θεραπεία με την ιματινίμπη.
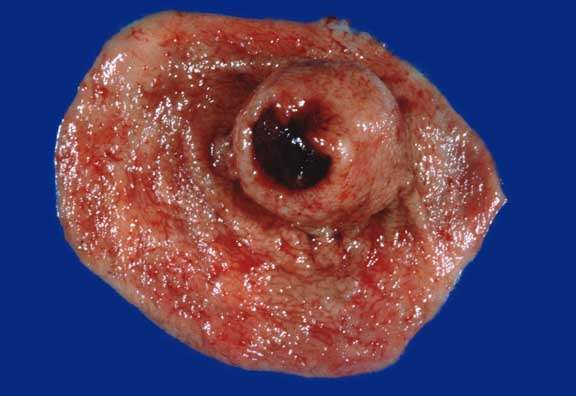
Οι γαστρεντερικοί στρωματικοί όγκοι (GISTs), αν και σχετικά σπάνιοι, αναγνωρίζονται ως οι συνηθέστεροι μεσεγχυματικοί όγκοι της γαστρεντερικής οδού. Η χειρουργική εκτομή, η παρέμβαση πρώτης γραμμής για χειρουργήσιμους γαστρεντερικούς στρωματικούς όγκους, αποτελούσε κατά παράδοση τη μόνη αποτελεσματική θεραπεία. Όσο για τη νόσο σε μεταστατικό στάδιο, οι εναλλακτικές θεραπείες συμπεριλαμβάνουν τη συστηματική χημειοθεραπεία και τη θεραπεία με ακτινοβολία. Ωστόσο, από άποψη μοριακής γενετικής, δηλαδή όσον αφορά τις μεταλλάξεις των γονιδίων που κωδικοποιούν για το KIT ή τον υποδοχέα α του αιμοπεταλιακού αυξητικού παράγοντα (PDGFRα), 2 υποδοχείς της τυροσινικής κινάσης (RTKs), έχουν μπει στο στόχαστρο θεραπευτικών παρεμβάσεων με ιματινίμπη (imatinib mesylate), έναν αναστολέα της κινάσης της τυροσίνης. Η θεραπεία μεταστατικών γαστρεντερικών στρωματικών όγκων με ιματινίμπη έχει επιφέρει ριζικές βελτιώσεις στο ελεύθερο υποτροπής διάστημα της νόσου και στη συνολική επιβίωση, θέτοντας συνεπώς τη χρήση της, στο πλαίσιο προεγχειρητικής και μετεγχειρητικής θεραπείας, υπό καθεστώς έντονης διερεύνησης.
Λέξεις ευρετηρίου: Γαστρεντερικός στρωματικός όγκος, χειρουργείο, ιματινίμπη.
ABSTRACT
Gastrointestinal Stromal Tumours (GISTs), while relatively rare, are recognised as the most common mesenchymal tumours of the gastrointestinal tract. Surgical resection, the first-line intervention for operable GISTs, was historically the only effective treatment. As for metastatic disease, treatment options include systemic chemotherapy and radiation therapy. However, their molecular genetics, i.e. the mutations of the genes coding for KIT or platelet-derived growth factor receptor α (PDGFRα), two receptor tyrosine kinases (RTKs), have been targeted for therapeutic intervention by imatinib mesylate, a tyrosine kinase inhibitor. Treatment of metastatic GIST with imatinib has led to dramatic improvements in progression-free and overall survival, thereby rendering its use in the preoperative and postoperative treatment under intense investigation.
Keywords: Gastrointestinal stromal tumour, surgery, imatinib
Εισαγωγή
Οι γαστρεντερικοί στρωματικοί όγκοι (GISTs), αν και σχετικά σπάνιοι, είναι οι συνηθέστεροι πρωτογενείς μεσεγχυματικοί όγκοι της γαστρεντερικής οδού. Η επίπτωση τους ανέρχεται σε σχεδόν 20 / 1.000.000 / έτος1, αν και έχει παρατηρηθεί μία 25πλάσια αύξηση της επίπτωσης ανάλογα με την ηλικία. Αυτό δεν οφείλεται μόνο στο γεγονός ότι οι όγκοι των λείων μυών έχουν ταξινομηθεί εκ νέου ως γαστρεντερικοί στρωματικοί όγκοι, όπως περιέγραψαν ερευνητές, οι οποίοι πρότειναν ότι στους στρωματικούς όγκους συγκαταλέγονται όγκοι με διαφοροποίηση των κυττάρων του Schwann ή «νευρωνική διαφοροποίηση» (γαστρεντερικοί όγκοι αυτόνομων νεύρων)2, αλλά και στο ότι η διάγνωση γαστρεντερικών μεσεγχυματικών όγκων ανάλογα με τον πληθυσμό και την ηλικία έχει αυξηθεί κατά τη διάρκεια της τελευταίας δεκαετίας3.
Οι γαστρεντερικοί στρωματικοί όγκοι εμφανίζονται κυρίως στο στομάχι (70%) και στο λεπτό έντερο (10-20%) και προέρχονται από πρωτόγονα κύτταρα με χαρακτηριστικά των διάμεσων κυττάρων Cajal (ICCs), των αυτόνομων κυττάρων-βηματοδοτών που ρυθμίζουν τον περισταλτισμό της πεπτικής οδού4,5. Η βιολογική τους συμπεριφορά είναι δύσκολο να προβλεφθεί, καθώς κυμαίνονται από καλοήθεις έως κακοήθεις, γεγονός που καθιστά το μέγεθος και το μιτωτικό τους δείκτη τους πλέον αξιόπιστους προγνωστικούς παράγοντες, βάσει των οποίων – καθώς και, σε κάποιο βαθμό, βάσει της ανατομικής θέσης των οποίων – προτάθηκε η ταξινόμηση των κινδύνων τους6,7,8 (Πίνακας 1).
Οι περισσότεροι γαστρεντερικοί στρωματικοί όγκοι (95%) εκδηλώνονται σε ενήλικες ηλικίας άνω των 40 ετών9. Παρ’ όλα αυτά, ορισμένοι γαστρεντερικοί στρωματικοί όγκοι εμφανίζονται σε παιδιά (ηλικίας 6-14 ετών) και νέους (ηλικίας 15-24 ετών), σε συνδυασμό με την τριάδα του Carney10 μαζί με νευροϊνωμάτωση11. Περιγράφονται επίσης σπάνιες περιπτώσεις οικογενών γαστρεντερικών στρωματικών όγκων12. Οι περισσότεροι ασθενείς που πάσχουν από γαστρεντερικούς στρωματικούς όγκους είναι ασυμπτωματικοί, αν και οι ασθενείς με προχωρημένη νόσο μπορεί να εμφανίσουν συμπτώματα μαζικής βλάβης, κοιλιακού πόνου ή αιμορραγίας. Τουλάχιστον 10-30% ανακαλύπτονται τυχαία κατά τη διάρκεια λαπαροτομής, ενδοσκόπησης ή άλλων εξετάσεων απεικόνισης13, ενώ 15-50% των γαστρεντερικών στρωματικών όγκων χαρακτηρίζονται από σαφώς μεταστατική νόσο14.
Μέθοδοι θεραπείας
Α. Χειρουργική επέμβαση
Η χειρουργική επέμβαση εξακολουθεί να αποτελεί την πρότυπη θεραπεία για όλες τις μη μεταστατικές βλάβες που επιδέχονται εκτομή, εφόσον μπορεί να διασωθεί η εύλογη λειτουργία του οργάνου15. Η ολική εκτομή του όγκου αποτελεί το σημαντικότερο παράγοντα για την έκβαση της θεραπείας και μπορεί να επιτευχθεί σε 40-60% όλων των ασθενών που πάσχουν από γαστρεντερικό στρωματικό όγκο και σε ≥70% εκείνων που πάσχουν από πρωτογενή, μη μεταστατική νόσο14,16. Ωστόσο, στοιχεία που απορρέουν από τη μακροπρόθεσμη παρακολούθηση ασθενών, οι οποίοι έχουν υποβληθεί σε χειρουργική εκτομή ενός γαστρεντερικού στρωματικού όγκου υψηλού κινδύνου, έδειξαν ότι σε γενικές γραμμές η χειρουργική επέμβαση από μόνη της δεν επιφέρει θεραπευτικά αποτελέσματα. Ένα ποσοστό 85-90% παρουσιάζουν κάποια δυσμενή έκβαση – υποτροπή, μετάστατικότητα ή θάνατο. Σε γενικές γραμμές, τοπικές υποτροπές ή μεταστάσεις αναπτύσσονται περίπου στους μισούς ασθενείς που υποβάλλονται σε δυνητικά θεραπευτικές επεμβάσεις για γαστρεντερικούς στρωματικούς όγκους, ανεξάρτητα από τη θέση του πρωτογενούς όγκου, ενώ τα ποσοστά επιβίωσης 5 και 10 ετών μετά από δυνητικά θεραπευτική χειρουργική επέμβαση ανέρχονται σε 32-78% και 19-63% αντιστοίχως14.
Ωστόσο, παρά τη χειρουργική εκτομή, η υποτροπή και εξάπλωση των γαστρεντερικών στρωματικών όγκων λαμβάνουν χώρα, στην πλειοψηφία των περιπτώσεων, μόνο ενδοκοιλιακά και καθίστανται εμφανείς κατά μέσο όρο 20 έως 25 μήνες μετά από την πρωτογενή εκτομή. Οι μεταστάσεις αναπτύσσονται συχνότερα στο ήπαρ, ενώ το περιτόναιο ή το επίπλουν συνιστούν τους αμέσως επόμενους συνηθέστερους στόχους. Ασύνηθες εύρημα συνιστά η εξωκοιλιακή εξάπλωση στους περιφερικούς λεμφαδένες, στους πνεύμονες, στα οστά ή σε υποδόρια σημεία17. Τα αποτελέσματα της χειρουργικής προοπτικής της υποτροπής ή εξάπλωσης των γαστρεντερικών στρωματικών όγκων ποικίλλουν και εξαρτώνται από παράγοντες, όπως το στάδιο της νόσου, τους παράγοντες κινδύνου του όγκου και η διάρκεια της ελεύθερου νόσου διαστήματος μετά από την αρχική εκτομή18. Όταν η κλινική αξιολόγηση υποδεικνύει ότι ένας ασθενής με υποτροπιάζοντα γαστρεντερικό στρωματικό όγκο θα μπορούσε να είναι υποψήφιος για χειρουργική επέμβαση, απαιτείται περιεκτική διαγνωστική απεικόνιση για λόγους προεγχειρητικής σταδιοποίησης. Στις περισσότερες περιπτώσεις, η υπολογιστική τομογραφία είναι ικανοποιητική για την ανάδειξη γαστρεντερικών στρωματικών όγκων στο ήπαρ, ενώ η τομογραφία εκπομπής ποζιτρονίων αποδεικνύεται πως αποτελεί μία ιδιαίτερα ευαίσθητη εξέταση σταδιοποίησης19. Ριζική χειρουργική εκτομή θα πρέπει να επιχειρείται σε επιλεγμένους ασθενείς, των οποίων η υποτροπιάζουσα ή μεταστατική νόσος εντοπίζεται σε ένα μεμονωμένο σημείο ή απαρτίζεται από βλάβες μικρού όγκου και πολλαπλών εστιών στις περιτοναϊκές επιφάνειες.
Οι χειρουργικές πρακτικές της διαχείρισης των γαστρεντερικών στρωματικών όγκων, όπως περιγράφονται στη διεθνή βιβλιογραφία20,21, παρατίθενται στον Πίνακα 2.
Β. Συμπληρωματική χημειοθεραπεία ή ακτινοθεραπεία
Η ακτινοβολία και η παραδοσιακή κυτταροτοξική χημειοθεραπεία διαδραματίζουν εξαιρετικά περιορισμένο ρόλο στη διαχείριση των γαστρεντερικών στρωματικών όγκων22. Εξαιτίας του ότι εντοπίζονται ενδοκοιλιακά, ο σχεδιασμός των πεδίων ακτινοβολίας είναι σχεδόν αδύνατος και συνεπάγεται σημαντική τοξικότητα για τα περιβάλλοντα όργανα. Απόπειρες θεραπείας των γαστρεντερικών στρωματικών όγκων με συστηματική χημειοθεραπεία υπήρξαν αντιστοίχως ανεπιτυχείς, αν και έχει υπάρξει κάποιο ενδιαφέρον για την εφαρμογή μη συμβατικών τεχνικών, όπως η ενδοπεριτοναϊκή έγχυση μιτοξαντρόνης και η χορήγηση φαρμάκων απευθείας μέσα στον όγκο με στόχο την απόφραξη της τροφοδότησης του με αίμα.
Γ. Μοριακή στοχευμένη θεραπεία
Οι περισσότεροι γαστρεντερικοί στρωματικοί όγκοι εκφράζουν την ογκοπρωτεΐνη της κινάσης της τυροσίνης KIT. Το ΚIT ανήκει στην υποομάδα των υποδοχέων τυροσινικής κινάσης τύπου ΙΙΙ, τα μέλη της οποίας συμπεριλαμβάνουν τους υποδοχείς α και β του αιμοπεταλιακού αυξητικού παράγοντα (PDGFRα και PDGFRβ). Η συνεχής ενεργοποίηση του KIT αποτελεί μία από τις πρώιμες διεργασίες μετασχηματισμού στους γαστρεντερικούς στρωματικούς όγκους και λαμβάνει χώρα κυρίως μέσα από μεταλλάξεις ενεργοποίησης στο γονίδιο kit, ωστόσο υπάρχουν στοιχεία που συνηγορούν υπέρ εναλλασσόμενων μηχανισμών ενεργοποίησης σε μία υποομάδα όγκων23. Μεταλλάξεις ενεργοποίησης του γονιδίου kit σε γαστρεντερικούς στρωματικούς όγκους πραγματοποιούνται στα εξόνια 11, 9, 13 και 17. Μάλιστα, η έκφραση του KIT είναι τόσο έντονη και συγκεκριμένη που έχει αποτελέσει αντικείμενο ισχυρισμών, σύμφωνα με τους οποίους απαιτείται για τη διάγνωση των γαστρεντερικών στρωματικών όγκων6,24, ενώ είναι πλέον σαφές ότι ένα μικρό, αλλά σημαντικό ποσοστό γαστρεντερικών στρωματικών όγκων (5-10%) είναι πράγματι αρνητικοί στο KIT25.
Ο PDGFRα σχετίζεται επίσης με την παθογένεση γαστρεντερικών στρωματικών όγκων και οι μεταλλάξεις στο c-kit είναι εξίσου αποκλειστικές με εκείνες στον pdgfra26,27. Οι συχνότερες μεταλλάξεις στον pdgfra παρατηρούνται στα εξόνια 18, 12 και 14.
Οι μεταλλάξεις ενεργοποίησης των γονιδίων kit και pdgfra σε διαφορετικά εξόνια έχουν κάποια σημασία, καθώς η πρωταρχική θέση ενός γαστρεντερικού στρωματικού όγκου σχετίζεται με τη διαφορική έκφραση μεταλλαγμένων ισομορφών KIT / PDGFRA από αυτόν28, με τους γαστρεντερικούς στρωματικούς όγκους που παρουσιάζουν μετάλλαξη στο εξόνιο 9 να εντοπίζονται στο κόλον και στο λεπτό έντερο και εκείνους που φέρουν μεταλλάξεις στο εξόνιο 18 ή D842 V να εντοπίζονται στο στομάχι και στο επίπλουν.
Γαστρεντερικοί στρωματικοί όγκοι και ιματινίμπη (imatinib mesylate)
Η σημασία της ενεργοποίησης του KIT υπογραμμίζεται από την πρόσφατη εφαρμογή ενός αναστολέα υποδοχέων τυροσινικής κινάσης, του STI-571 ή imatinib mesylate. Το imatinib mesylate είναι ένας αναστολέας υποδοχέων κινάσης που είχε εγκριθεί στο παρελθόν (2001) από τη Διεύθυνση Τροφίμων και Φαρμάκων των Ηνωμένων Πολιτειών της Αμερικής (FDA) για τη θεραπεία της χρόνιας μυελογενούς λευχαιμίας σε βλαστική κρίση (επιταχυνόμενη φάση) ή σε χρόνια φάση μετά από αποτυχημένη θεραπεία με ιντερφερόνη-α (IFN-a). Ωστόσο, το 2001, η ιματινίμπη εγκρίθηκε από τη Διεύθυνση Τροφίμων και Φαρμάκων των Η.Π.Α. και για τη θεραπεία κακοήθων μεταστατικών και / ή μη επιδεχόμενων εκτομή γαστρεντερικών στρωματικών όγκων.
Αφού αποδείχτηκε μία αντικειμενική ανταπόκριση σε άνω του 50% των ασθενών, η ιματινίμπη κατέστη ταχύτατα η προτιμώμενη θεραπεία σε ασθενείς με προχωρημένους μη επιδεχόμενους εκτομή ή μεταστατικούς γαστρεντερικούς στρωματικούς όγκους. Παρατηρήθηκε αναστολή της ανάπτυξης των όγκων σε όλους τους ασθενείς, εξαιρουμένων 4 στους 40, με γαστρεντερικούς στρωματικούς όγκους, με την ιματινίμπη σε δοσολογία 400 mg δις ημερησίως να παρουσιάζει καλή ανεκτικότητα κατά τη διάρκεια των πρώτων 8 εβδομάδων, με τις παρενέργειες να ελαττώνονται μέσα από συνεχιζόμενη θεραπεία29.
Ερευνητές εκτίμησαν και την ανταπόκριση ενάντια στον όγκο και την ασφάλεια και ανεκτικότητα του φαρμάκου30. Παρά το γεγονός ότι κανένας ασθενής δεν παρουσίασε πλήρη ανταπόκριση στη θεραπεία, 53,7% παρουσίασαν μερική ανταπόκριση, ενώ η διάμεση διάρκεια ανταπόκρισης δεν είχε επιτευχθεί μετά από μία διάμεση διάρκεια παρακολούθησης 24 εβδομάδων μετά από την εκδήλωση. Η θεραπεία παρουσίασε καλή ανεκτικότητα, αν εξαιρεθεί το γεγονός ότι εκδηλώθηκε γαστρεντερική ή περιτοναϊκή αιμορραγία σε 5% των ασθενών, πιθανότατα συνεπεία νέκρωσης του όγκου που προκλήθηκε από την ιματινίμπη, γεγονός που καθιστά την αναστολή του μονοπατιού μεταγωγής του σήματος του KIT μία πολλά υποσχόμενη θεραπεία για προχωρημένους γαστρεντερικούς στρωματικούς όγκους, οι οποίοι αντιστέκονται στη συμβατική χημειοθεραπεία. Έχουν αναφερθεί ταχέα και ριζικά αποτελέσματα, συμπεριλαμβανομένης μίας μείωσης του μεγέθους του όγκου της τάξης του 52% και μίας πλήρους μεταβολικής ανταπόκρισης που ανέδειξε τομογραφία εκπομπής ποζιτρονίων μετά από 4 εβδομάδες θεραπείας με ιματινίμπη31.
Όσον αφορά την τοξικότητα της, μία πρόσφατη μελέτη σε ασθενείς με προχωρημένους γαστρεντερικούς στρωματικούς όγκους, έδειξε με σαφήνεια ότι ο κίνδυνος μη αιματολογικής τοξικότητας εξαρτήθηκε από τη δοσολογία και ήταν υψηλότερος σε γυναίκες (οίδημα, ναυτία, διάρροια) και σε ασθενείς προχωρημένης ηλικίας (οίδημα, εξάνθημα, κόπωση) με μειωμένη απόδοση (κόπωση και ναυτία), με ιστορικό χημειοθεραπείας (κόπωση), με όγκο εντοπισμένης γαστρεντερικής προέλευσης (διάρροια) και με μικρές βλάβες (εξάνθημα), ενώ περιπτώσεις αιματολογικής τοξικότητας, όπως η αναιμία, συσχετίστηκαν με τη δοσολογία και τα επίπεδα γραμμής αναφοράς της αιμοσφαιρίνης και άλλες, όπως η ουδετεροπενία, με τα επίπεδα γραμμής αναφοράς του αριθμού των ουδετερόφιλων και της αιμοσφαιρίνης32.
Πρόσφατα αναφέρθηκε πλήρης ανταπόκριση στην ιματινίμπη σε ασθενείς με προχωρημένο γαστρεντερικό στρωματικό όγκο. Σε μία περίπτωση ασθενούς με γαστρεντερικό στρωματικό όγκο επιτεύχθηκε ολοκληρωτική ύφεση, η οποία και προσδιορίστηκε από ιστοπαθολογική άποψη ως η απουσία βιώσιμων κυττάρων του όγκου σε δείγματα βιοψίας από τη μεγαλύτερη υπολειμματική μάζα, μετά από 5 μήνες θεραπείας με ιματινίμπη 400 mg ημερησίως33. Τα αποτελέσματα μίας προγραμματισμένης ενδιάμεσης ανάλυσης που συνέκρινε 2 δόσεις ιματινίμπης για τη θεραπεία προχωρημένου γαστρεντερικού στρωματικού όγκου ανέδειξαν πλήρη ανταπόκριση του όγκου σε 3% και 2% των ασθενών αντιστοίχως, μετά από μία διάμεση διάρκεια παρακολούθησης 8,4 μηνών34. Παθολογοανατομική πλήρης ανταπόκριση αναφέρθηκε μετά από 13 μήνες θεραπείας με ιματινίμπη35.
Προεγχειρητική θεραπεία με ιματινίμπη
Η θεραπεία με ιματινίμπη μελετήθηκε επίσης, σε συνδυασμό με την εκτομή τεχνικά ανεγχείρητων γαστρεντερικών στρωματικών όγκων, εξαιτίας της διήθησης περιβαλλόντων οργάνων και της παρουσίας μετάστασης, με τη μορφή προεγχειρητικής θεραπείας. Πλήρης παθολογική ανταπόκριση αναφέρθηκε σε έναν ασθενή, στην περίπτωση του οποίου η χειρουργική εκτομή του γαστρεντερικού στρωματικού όγκου ήταν τεχνικά ανέφικτη και ο οποίος ξεκίνησε θεραπεία με ιματινίμπη (400 mg ημερησίως)36. Οι υπολογιστικές τομογραφίες έδειξαν σημαντική υποχώρηση του όγκου, γεγονός που επέτρεψε την εκτομή του μετά από 6 μήνες, με τον ασθενή να βρίσκεται σε καλή φυσική κατάσταση και χωρίς ενδείξεις υποτροπής του όγκου, καθώς και με συνεχιζόμενη θεραπεία με ιματινίμπη, 16 μήνες μετά από τη χειρουργική επέμβαση και 23 μήνες μετά από τη διάγνωση.
Σε άλλες δοκιμές της θεραπείας με ιματινίμπη σε ασθενείς με γαστρεντερικούς στρωματικούς όγκους, περιγράφηκαν προσεγγίσεις συνδυασμένης θεραπείας, συμπεριλαμβανομένης της χειρουργικής εκτομής μετά από θεραπεία με ιματινίμπη σε ασθενείς με προχωρημένη μεταστατική νόσο. Οι συγγραφείς ανέφεραν μία σειρά 90 ασθενών με μεταστατικό γαστρεντερικό στρωματικό όγκο, στο πλαίσιο της οποίας η θεραπεία με ιματινίμπη επέτρεψε σε 12 ασθενείς με υποτροπιάζουσα και εκτεταμένη νόσο να κριθούν κατάλληλοι για εκτομή της υπολειμματικής νόσου. Σε 11 από αυτούς τους ασθενείς κατέστη εφικτή η πλήρης εκτομή37. Έχουν δημοσιευτεί αμέτρητες άλλες αναφορές εκτομής μεταστάσεων σε ασθενείς με γαστρεντερικούς στρωματικούς όγκους μετά από θεραπεία με ιματινίμπη38,39, ωστόσο ο ρόλος του εν λόγω παράγοντα ως προεγχειρητικής θεραπείας σε μεταστατικούς γαστρεντερικούς στρωματικούς όγκους δεν έχει προσδιοριστεί ακόμα.
Όσον αφορά την ανταπόκριση στη δοσολογία, οι δοκιμές φάσης ΙΙΙ με ιματινίμπη υψηλής δόσης (800 mg/d) δείχνουν ότι ορισμένοι ασθενείς που μετάβηκαν στην υψηλότερη δόση από εκείνη των 400 mg/d εξαιτίας αποτυχίας της θεραπείας ή εξέλιξης της νόσου σημείωσαν σταθεροποίηση της νόσου ή ανταπόκριση. Λίγοι από τους εν λόγω ασθενείς εξακολούθησαν να λαμβάνουν θεραπεία 12 ή περισσότερους μήνες μετά από τη μετάβαση στην υψηλότερη δόση40, 41. Ωστόσο, πιο πρόσφατα αποτελέσματα έδειξαν ότι το κλινικό όφελος της αύξησης της δοσολογίας σε 800 mg μετά από εξέλιξη της νόσου με 400 mg ήταν ασαφές, παρά το γεγονός ότι μία υποομάδα ασθενών παρουσίασε αντικειμενική ανταπόκριση με συνεχιζόμενη δοσολογία ιματινίμπης. Μελλοντικές μελέτες αναμένεται να προσδιορίσουν τη βέλτιστη διαχείριση των ασθενών που πάσχουν από γαστρεντερικούς στρωματικούς όγκους42. Παρά την αυξημένη κόπωση και αναιμία, η μείωση της δοσολογίας δεν απαιτήθηκε παρά μόνο σε 31% των ασθενών εντός ενός έτους43. Ο δυνητικός ρόλος μίας υψηλής δόσης ιματινίμπης (800 mg/d) για γαστρεντερικούς στρωματικούς όγκους με μεταλλάξεις του KIT στο εξόνιο 9 επιβεβαιώθηκε από μία πρόσφατη κλινική δοκιμή, τα ευρήματα της οποίας υπέδειξαν την ανάγκη εξατομικευμένης θεραπείας ασθενών με γαστρεντερικούς στρωματικούς όγκους, με τους ασθενείς που χαρακτηρίζονται από μεταλλάξεις του KIT στο εξόνιο 9 να ωφελούνται περισσότερο από την ημερήσια δόση 800 mg του φαρμάκου44.
Δεν είναι μόνο οι ασθενείς με μεταλλάξεις του KIT στο εξόνιο 9 που μπορούν να ωφεληθούν πιθανώς από ένα συγκεκριμένο φαρμακευτικό σχήμα· πρωτοποριακές κλινικές μελέτες δείχνουν επίσης ότι υπάρχει συσχετισμός ανάμεσα στο γονότυπο-στόχο της κινάσης και στην κλινική δραστηριότητα της ιματινίμπης σε ασθενείς με μεταστατικούς γαστρεντερικούς στρωματικούς όγκους που εκφράζουν το KIT. Ειδικότερα, μεταλλάξεις ενεργοποίησης του kit ή pdgfra εντοπίζονται στη συντριπτική πλειοψηφία γαστρεντερικών στρωματικών όγκων θετικών στο KIT (KIT+), ενώ ο γονότυπος όγκων με μεταλλάξεις του kit στο εξόνιο 11 συσχετίζεται με την πλέον ευνοϊκή κλινική ανταπόκριση στην ιματινίμπη45.
Η ελλάτωση τοπικών υποτροπών και μεταστάσεων, η επιμήκυνση διαστημάτων ελεύθερων νόσου και της συνολικής επιβίωσης, η αύξηση του αριθμού των ασθενών που πληρούν τις προϋποθέσεις εκτομής με τη βοήθεια φαρμακευτικής ογκομείωσης και η ενδεχόμενη βελτίωση της ανταπόκρισης στην ιματινίμπη μέσω χειρουργικής κυτταρομείωσης δημιουργούν το κατάλληλο πλαίσιο για την αντιμετώπιση των γαστρεντερικών στρωματικών όγκων46. Ερευνητές μεταφέρουν την εμπειρία τους από χειρουργικές επεμβάσεις, στις οποίες υπέβαλαν 18 ασθενείς που έπασχαν από γαστρεντερικούς στρωματικούς όγκους με υπολειμματικές μάζες όγκων μετά από θεραπεία με ιματινίμπη, γεγονός που αποδείχτηκε σοβαρότατο εγχείρημα, το οποίο και συμπεριλάμβανε διαδικασίες, όπως εκτομή του ήπατος, εκτομή πολλαπλών οργάνων και πυελική εξεντέρωση47. Ωστόσο, σε 7 στους 8 ασθενείς με συνεχιζόμενη μερική ύφεση κατά τη χρονική στιγμή της χειρουργικής επέμβασης επιτεύχθηκε ιστολογικά πλήρης R0 εκτομή (χειρουργική εκτομή με θεραπευτικό σκοπό), ενώ από αυτούς μόνο ένας ασθενής παρουσίασε εξέλιξη της νόσου κατά τη χρονική στιγμή αναφοράς των αποτελεσμάτων. Τα αποτελέσματα σε ασθενείς με εξελικτική νόσο κατά τη χρονική στιγμή της χειρουργικής επέμβασης ήταν σχετικά περιορισμένα. Τα εν λόγω δεδομένα επιβεβαιώνουν την αξία του συνδυασμού χειρουργικής επέμβασης και ιματινίμπης σε ασθενείς που παρουσιάζουν ανταπόκριση.
Ορόλος της ιματινίμπης σε συνδυασμό με τη χειρουργική επέμβαση σε πρωτογενείς ή μεταστατικούς γαστρεντερικούς στρωματικούς όγκους παρουσιάζεται συνοπτικά στον Πίνακα 3.
Αντίσταση στην ιματινίμπη
Αν και η πλειοψηφία των ασθενών που πάσχουν από μεταστατικό γαστρεντερικό στρωματικό όγκο αρχικά ανταποκρίνονται στην ιματινίμπη, υποτροπή ή εξέλιξη της νόσου παρατηρείται στους περισσότερους ασθενείς και μόνο ένα ποσοστό περίπου 30-40% των ασθενών εκδηλώνουν μηδενική εξέλιξη του όγκου 24 μήνες μετά από την έναρξη της θεραπείας48,49. Αυτό οφείλεται στο γεγονός ότι οι περισσότεροι από αυτούς αναπτύσσουν κάποια αντίσταση μετά από μεταβλητά επίπεδα αρχικής ανταπόκρισης στη θεραπεία34.
Το φαινόμενο «οζίδιο εντός μίας προϋπάρχουσας μάζας», («nodule within a mass»), αποτελεί ένα μοναδικό φαινόμενο εξέλιξης της νόσου που παρατηρείται σε ασθενείς με γαστρεντερικό στρωματικό όγκο μετά από μία αρχική ανταπόκριση στην ιματινίμπη και αντικατοπτρίζει την εμφάνιση «κλώνων» που αντιστέκονται στην ιματινίμπη, η οποία και υποστηρίζεται από την εκδήλωση δευτερογενών μεταλλάξεων στο γονότυπο του όγκου. Η εν λόγω κλωνική εξέλιξη της αντίστασης στην ιματινίμπη, η οποία εμφανίζεται ως ένα νέο ενισχυμένο οζίδιο που αναπτύσσεται εντός μίας προϋπάρχουσας μάζας όγκου θα πρέπει να ταξινομείται ως «νέα βλάβη» ή υποτροπή και να σηματοδοτεί τουλάχιστον τη μερική εξέλιξη του γαστρεντερικού στρωματικού όγκου50.
Θα πρέπει να διακρίνουμε 2 είδη αντίστασης51: (1) Πρωτογενής αντίσταση: Ενδείξεις εξέλιξης της νόσου εντός των πρώτων 6 μηνών θεραπείας με ιματινίμπη, οι οποίες συχνά σχετίζονται με μία πρωτεΐνη του KIT άγριου τύπου. (2) Δευτερογενής αντίσταση: Εξέλιξη της νόσου μετά από 6 μήνες θεραπείας. Οι μηχανισμοί δευτερογενούς αντίστασης είναι ετερογενείς: (α) δευτερογενής μετάλλαξη στα γονίδια kit ή pdgfra52,53, (β) γονιδιωματική ενίσχυση του kit και υπερέκφραση της πρωτεΐνης53, και (γ) ενεργοποίηση άλλων υποδοχέων τυροσινικής κινάσης54. Μία νέα γενιά αναστολέων της κινάσης της τυροσίνης έχει τεθεί επί του παρόντος υπό αξιολόγηση με στόχο την επίλυση του εν λόγω προβλήματος55,56 και νέες κλινικές δοκιμές έχουν ήδη ξεκινήσει, οι οποίες ερευνούν νέες θεραπευτικές φαρμακευτικές προσεγγίσεις57,58,59. Επιπλέον, η πρωτεϊνική κινάση C θήτα (prkcθ) ενεργοποιείται συνεχώς σε γαστρεντερικούς στρωματικούς όγκους και ως εκ τούτου θα μπορούσε να αποτελέσει θεραπευτικό στόχο60.
Διαφορετικοί μηχανισμοί αντίστασης μπορεί να προβλέπονται μέσα από διαφορετικούς προγνωστικούς παράγοντες, όπως δήλωσαν ερευνητές, οι οποίοι εντόπισαν παράγοντες που προβλέπουν την αρχική και μεταγενέστερη αντίσταση των ασθενών που πάσχουν από γαστρεντερικούς στρωματικούς όγκους στην ιματινίμπη61 (Πίνακας 4).
Συμπεράσματα
Η ιματινίμπη μπορεί να χρησιμοποιηθεί από ομάδες ιατρών με εμπειρία στη διαχείριση των γαστρεντερικών στρωματικών όγκων, στη θεραπεία με ιματινίμπη και στις χειρουργικές επεμβάσεις για όγκους της πεπτικής οδού, ειδικότερα όταν απώτερος σκοπός είναι η χειρουργική επέμβαση που διασώζει κάποια λειτουργία. Ωστόσο, δεν υπάρχουν δεδομένα που να υποστηρίζουν τη χρήση προεγχειρητικής θεραπείας με ιματινίμπη στο βαθμό που οποιαδήποτε μείωση του μεγέθους του όγκου δεν επηρεάζει τη χειρουργική επέμβαση. Αντιθέτως, σε ορισμένους ασθενείς που πάσχουν από γαστρεντερικούς στρωματικούς όγκους, οι οποίοι είτε δεν επιδέχονται εκτομή είτε η χειρουργική επέμβαση επί των οποίων θα είχε ως αποτέλεσμα μία σημαντική απώλεια της λειτουργίας ενός οργάνου, μπορεί να χορηγηθεί προεγχειρητική θεραπεία με ιματινίμπη στο πλαίσιο μίας προσπάθειας να επιτευχθεί κυτταρομείωση και να διατηρηθεί η λειτουργία του οργάνου. Στις εν λόγω περιπτώσεις, θα πρέπει να διενεργείται μία προσεκτική εκτίμηση της κατάστασης πριν από τη θεραπεία και της ταχείας ανταπόκρισης στη θεραπεία με τη βοήθεια τομογραφίας εκπομπής ποζιτρονίων και υπολογιστικής τομογραφίας. Εξαιτίας των δυσκολιών κατά την αξιολόγηση της ανταπόκρισης του όγκου και του κινδύνου πρωτογενούς αντίστασης, η προεγχειρητική θεραπεία με ιματινίμπη δεν μπορεί να εκληφθεί ως διαδικασία ρουτίνας και θα πρέπει να χορηγείται μόνο από μία εξειδικευμένη ομάδα ιατρών ειδικών στη διαχείριση σαρκωμάτων και γαστρεντερικών στρωματικών όγκων51.
Θα πρέπει να γίνει μία διάκριση ανάμεσα στους εν λόγω ασθενείς και σε 2 διαφορετικές υποομάδες ασθενών: (i) εκείνους που πάσχουν από γαστρεντερικούς στρωματικούς όγκους επιδεχόμενους εκτομή και που θα λάμβαναν προεγχειρητική θεραπεία με ιματινίμπη απλώς και μόνο με στόχο την εξάλειψη εικαζόμενης υποκλινικής νόσου· αυτή η τελευταία περίπτωση εξακολουθεί να αποτελεί πειραματική προσέγγιση, και (ii) εκείνους, των οποίων η μεταστατική νόσος υποβάλλεται σε χειρουργική εκτομή μετά από μία χρονική περίοδο θεραπείας με ιματινίμπη· αυτή η τελευταία περίπτωση θα πρέπει να εκλαμβάνεται ως χειρουργική επέμβαση επί υπολειμματικής νόσου μετά από μοριακή στοχευμένη θεραπεία για μεταστατικό γαστρεντερικό στρωματικό όγκο.
Βάσει μίας τυχαιοποιημένης δοκιμής διακοπής της θεραπείας σε ασθενείς με προχωρημένο γαστρεντερικό στρωματικό όγκο που αναφέρθηκε πρόσφατα62,63, η θεραπεία με ιματινίμπη πρέπει πάντα να συνεχίζεται, ακόμα και μετά από ολοκληρωτική εκτομή της ορατής νόσου στο σύνολο της. Η χρήση ακτινοθεραπείας ως προεγχειρητικής ή συμπληρωματικής θεραπείας για γαστρεντερικούς στρωματικούς όγκους δεν τεκμηριώνεται στη βιβλιογραφία.
Όσον αφορά τη μη επιδεχόμενη εκτομή και / ή μεταστατική νόσο, έχει συμφωνηθεί να συστήνεται άμεση θεραπεία με ιματινίμπη. Η ιματινίμπη συνιστά επίσης την προτιμώμενη θεραπεία μετά από εκτομή μετάστασης σε ασθενείς με γαστρεντερικούς στρωματικούς όγκους.
Τέλος, όσον αφορά τη χειρουργική εκτομή υπολειμματικής μετάστασης σε ασθενείς, στους οποίους η προχωρημένη νόσος ελέγχεται με ιματινίμπη, δεν υπάρχουν στοιχεία που να υποδεικνύουν επί του παρόντος ότι η χειρουργική επέμβαση μπορεί από μόνη της να θεραπεύσει τους προχωρημένους γαστρεντερικούς στρωματικούς όγκους. Στην περίπτωση ασθενών που παρουσιάζουν ανταπόκριση ή παρατεταμένη σταθερή νόσο ή εκείνων που δεν ανταποκρίνονται στην ιματινίμπη, η χειρουργική επέμβαση επιλέγεται εάν μπορούν να αφαιρεθούν όλοι οι ορατοί όγκοι και διενεργείται σε γενικές γραμμές μόλις επιτευχθεί η μέγιστη ανταπόκριση στην ιματινίμπη.
Η διακοπή της ιματινίμπης μετά από 1 χρόνο σχετίζεται με υψηλό κίνδυνο υποτροπής, ακόμα και για ασθενείς με ολοκληρωτική ύφεση62. Παρά το γεγονός ότι οι περισσότεροι ασθενείς (όχι όμως όλοι) ανταποκρίνονται στην εκ νέου χορήγηση ιματινίμπης, η χορήγηση του φαρμάκου δεν θα πρέπει να διακόπτεται. Για αυτό το λόγο, θα πρέπει να χορηγείται ιματινίμπη έως την εξέλιξη της νόσου, δυσανεξία ή άρνηση του ασθενούς.
Αν και πολλοί ασθενείς που συμμορφώνονται με τη θεραπεία με ιματινίμπη και ανέχονται τις παρενέργειες της μπορούν να συνεχίσουν για λίγα χρόνια με περιορισμένη ή μηδενική εξέλιξη της νόσου στην περίπτωση μη επιδεχόμενων εκτομή / μεταστατικών γαστρεντερικών στρωματικών όγκων ή με μηδενική υποτροπή στην περίπτωση γαστρεντερικών στρωματικών όγκων επιδεχόμενων εκτομή34, η επιβίωση ελεύθερη προόδου της νόσου τοποθετείται έως τώρα σε μία διάμεση τιμή 5 μηνών. Το ίδιο, ωστόσο, δεν ισχύει για ασθενείς που μεταβαίνουν από 400 mg σε 800 mg ημερησίως, καθώς η διάμεση επιβίωση ελεύθερης προόδου της νόσου κυμαίνεται σε ακόμα χαμηλότερα επίπεδα, από 3 έως 4 μήνες42,43. Νέοι παράγοντες υπό έρευνα αναπτύσσονται και η συμμετοχή σε πολλά υποσχόμενες κλινικές δοκιμές εξακολουθεί να συνιστά πρότυπο θεραπείας.
ΒΙΒΛΙΟΓΡΑΦΙΑ
[1] Nilsson B, Bumming P, Meis-Kindblom JM, et al. Gastrointestinal stromal tumors: the incidence, prevalence, clinical course, and prognostication in the preimatinib mesylate era–a population-based study in western Sweden. Cancer 2005;103:821-829.
[2] Mazur MT, Clark HB. Gastric stromal tumors. Reappraisal of histogenesis. Am J Surg Pathol 1983;7:507-519.
[3] Perez EA, Livingstone AS, Franceschi D, et al. Current incidence and outcomes of gastrointestinal mesenchymal tumors including gastrointestinal stromal tumors. J Am Coll Surg 2006;202:623-629.
[4] Kindblom LG, Remotti HE, Aldenborg F, et al. Gastrointestinal pacemaker cell tumor (GIPACT): gastrointestinal stromal tumors show phenotypic characteristics of the interstitial cells of Cajal. Am J Pathol 1998;152:1259-1269.
[5] Sircar K, Hewlett BR, Huizinga JD, et al. Interstitial cells of Cajal as precursors of gastrointestinal stromal tumors. Am J Surg Pathol 1999;23:377-389.
[6] Fletcher CD, Berman JJ, Corless C, et al. Diagnosis of gastrointestinal stromal tumors: A consensus approach. Hum Pathol 2002;33:459-465.
[7] Miettinen M, Lasota J, Sobin LH. Gastrointestinal stromal tumors of the stomach: a clinicopathologic, immunohistochemical, and molecular genetic study of 1765 cases with long-term follow-up. Am J Surg Pathol 2005;29:52-68.
[8] Miettinen M, Kopczynski J, Makhlouf HR, et al. Gastrointestinal stromal tumors, intramural leiomyomas, and leiomyosarcomas in the duodenum: a clinicopathologic, immunohistochemical, and molecular genetic study of 167 cases. Am J Surg Pathol 2003;27:625-641.
[9] Tran T, Davila JA, El-Serag HB. The epidemiology of malignant gastrointestinal stromal tumors: an analysis of 1,458 cases from 1992 to 2000. Am J Gastroenterol 2005;100:162-168.
[10] Carney JA, Stratakis CA. Familial paraganglioma and gastric stromal sarcoma: a new syndrome distinct from the Carney triad. Am J Med Genet 2002;108:132-139.
[11] Maertens O, Prenen H, Debiec-Rychter M, et al. Molecular pathogenesis of multiple gastrointestinal stromal tumors in NF1 patients. Hum Mol Genet 2006;15:1015-1023.
[12] Li FP, Fletcher JA, Heinrich MC, et al. Familial gastrointestinal stromal tumor syndrome: phenotypic and molecular features in a kindred. J Clin Oncol 2005;23:2735-2743.
[13] Davila RE, Faigel DO. GI stromal tumors. Gastrointest Endosc 2003;58:80-88.
[14] Roberts PJ, Eisenberg B. Clinical presentation of gastrointestinal stromal tumors and treatment of operable disease. Eur J Cancer 2002;38 Suppl 5:S37-38.
[15] Eisenberg BL, Judson I. Surgery and imatinib in the management of GIST: emerging approaches to adjuvant and neoadjuvant therapy. Ann Surg Oncol 2004;11:465-475.
[16] Pierie JP, Choudry U, Muzikansky A, et al. The effect of surgery and grade on outcome of gastrointestinal stromal tumors. Arch Surg 2001;136:383-389.
[17] Crosby JA, Catton CN, Davis A, et al. Malignant gastrointestinal stromal tumors of the small intestine: a review of 50 cases from a prospective database. Ann Surg Oncol 2001;8:50-59.
[18] DeMatteo RP, Lewis JJ, Leung D, et al. Two hundred gastrointestinal stromal tumors: recurrence patterns and prognostic factors for survival. Ann Surg 2000;231:51-58.
[19] Burkill GJ, Badran M, Al-Muderis O, et al. Malignant gastrointestinal stromal tumor: distribution, imaging features, and pattern of metastatic spread. Radiology 2003;226:527-532.
[20] Kosmadakis N, Visvardis EE, Kartsaklis P, et al. The role of surgery in the management of gastrointestinal stromal tumors (GISTs) in the era of imatinib mesylate effectiveness. Surg Oncol 2005;14:75-84.
[21] Moiz SR, Ganesan BH, Lee TD. Laparoendoscopic removal of a benign gastric stromal tumor at the cardia. JSLS 2006;10:117-121.
[22] Joensuu H, Fletcher C, Dimitrijevic S, et al. Management of malignant gastrointestinal stromal tumours. Lancet Oncol 2002;3:655-664.
[23] Tornillo L, Terracciano LM. An update on molecular genetics of gastrointestinal stromal tumours. J Clin Pathol 2006;59:557-563.
[24] Miettinen M, Majidi M, Lasota J. Pathology and diagnostic criteria of gastrointestinal stromal tumors (GISTs): a review. Eur J Cancer 2002;38 Suppl 5:S39-51.
[25] Debiec-Rychter M, Wasag B, Stul M, et al. Gastrointestinal stromal tumours (GISTs) negative for KIT (CD117 antigen) immunoreactivity. J Pathol 2004;202:430-438.
[26] Sihto H, Franssila K, Tanner M, et al. Platelet-derived growth factor receptor family mutations in gastrointestinal stromal tumours. Scand J Gastroenterol 2006;41:805-811.
[27] Heinrich MC, Corless CL, Duensing A, et al. PDGFRA activating mutations in gastrointestinal stromal tumors. Science 2003;299:708-710.
[28] Wasag B, Debiec-Rychter M, Pauwels P, et al. Differential expression of KIT/PDGFRA mutant isoforms in epithelioid and mixed variants of gastrointestinal stromal tumors depends predominantly on the tumor site. Mod Pathol 2004;17:889-894.
[29] van Oosterom AT, Judson I, Verweij J, et al; European Organisation for Research and Treatment of Cancer Soft Tissue and Bone Sarcoma Group. Safety and efficacy of imatinib (STI571) in metastatic gastrointestinal stromal tumours: a phase I study. Lancet 2001;358:1421-1423.
[30] Demetri GD, von Mehren M, Blanke CD, et al. Efficacy and safety of imatinib mesylate in advanced gastrointestinal stromal tumors. N Engl J Med 2002;347:472-480.
[31] Van den Abbeele AD, Badawi RD. Use of positron emission tomography in oncology and its potential role to assess response to imatinib mesylate therapy in gastrointestinal stromal tumors (GISTs). Eur J Cancer 2002;38 Suppl 5:S60-65.
[32] Glabbeke MV, Verweij J, Casali PG, et al. Predicting toxicities for patients with advanced gastrointestinal stromal tumours treated with imatinib: A study of the European Organisation for Research and Treatment of Cancer, the Italian Sarcoma Group, and the Australasian Gastro-Intestinal Trials Group (EORTC-ISG-AGITG). Eur J Cancer 2006 Jul 26;[Epub ahead of print]
[33] Hogenauer C, Langner C, Lipp RW, et al. Complete remission of a metastatic gastrointestinal stromal tumour with the tyrosine kinase inhibitor imatinib (STI 571): effect of low dosage in an advanced tumour with exon 11 mutation. Eur J Gastroenterol Hepatol 2003;15:323-327.
[34] Verweij J, Casali PG, Zalcberg J, et al. Progression-free survival in gastrointestinal stromal tumours with high-dose imatinib: randomised trial. Lancet 2004;364:1127-1134.
[35] Chacon M, Roca E, Huertas E, et al. CASE 3. Pathologic complete remission of metastatic gastrointestinal stromal tumor after imatinib mesylate. J Clin Oncol 2005;23:1580-1582.
[36] Melichar B, Voboril Z, Nozicka J, et al. Pathological complete response in advanced gastrointestinal stromal tumor after imatinib therapy. Intern Med 2005;44:1163-1168.
[37] Bauer S, Hartmann JT, de Wit M, et al. Resection of residual disease in patients with metastatic gastrointestinal stromal tumors responding to treatment with imatinib. Int J Cancer 2005;117:316-325.
[38] Bumming P, Andersson J, Meis-Kindblom JM, et al. Neoadjuvant, adjuvant and palliative treatment of gastrointestinal stromal tumours (GIST) with imatinib: a centre-based study of 17 patients. Br J Cancer 2003;89:460-464.
[39] Scaife CL, Hunt KK, Patel SR, et al. Is there a role for surgery in patients with “unresectable” cKIT+ gastrointestinal stromal tumors treated with imatinib mesylate? Am J Surg 2003;186:665-669.
[40] Verweij J, Casali P, Zalcberg J, et al. Early efficacy comparison of two doses of imatinib for the treatment of advanced gastrointestinal stromal tumors (GIST): interim results of a randomized phase III trial from the EORTC-STBSG, ISG, and AGITG. Proc Am Soc Clin Oncol 2003;22:814.
[41] Benjamin RS, Rankin C, Fletcher C, et al. Phase III dose-randomized study of imatinib mesylate (STI571) for GIST: Intergroup S0033 early results. Proc Am Soc Clin Oncol 2003;22:814.
[42] Rankin C, von Mehren M, Blanke C, et al. Collaborating Investigators of the North American Sarcoma Intergroup. Dose effect of imatinib (IM) in patients (pts) with metastatic GIST – Phase III Sarcoma Group Study S0033. Proc Am Soc Clin Oncol 2004;22:9005.
[43] Zalcberg J, Verweij J, Casali PG, et al. Outcome of patients with advanced gastro-intestinal stromal tumors (GIST) crossing over to a daily imatinib dose of 800mg (HD) after progression on 400mg (LD) – an international, intergroup study of the EORTC, ISG and AGITG. Proc Am Soc Clin Oncol 2004;22:9004.
[44] Debiec-Rychter M, Sciot R, Le Cesne A, et al; EORTC Soft Tissue and Bone Sarcoma Group; The Italian Sarcoma Group; Australasian GastroIntestinal Trials Group. KIT mutations and dose selection for imatinib in patients with advanced gastrointestinal stromal tumours. Eur J Cancer 2006;42(8):1093-1103.
[45] Heinrich MC, Shoemaker JS, Corless CL, et al. Correlation of target kinase genotype with clinical activity of imatinib mesylate (IM) in patients with metastatic GI stromal tumors (GISTs) expressing KIT (KIT+). Proc Am Soc Clin Oncol 2005;23:7.
[46] Eisenberg BL, von Mehren M. Pharmacotherapy of gastrointestinal stromal tumours. Expert Opin Pharmacother 2003;4:869-874.
[47] Hohenberg BL, Bauer S, Schneider U, et al. Tumor resection following imatinib pretreatment in GI stromal tumors. Proc Am Soc Clin Oncol 2003;22:818.
[48] Heinrich MC, Corless CL, Demetri GD, et al. Kinase mutations and imatinib response in patients with metastatic gastrointestinal stromal tumor. J Clin Oncol 2003;21:4342-4349.
[49] Wu PC, Langerman A, Ryan CW, et al. Surgical treatment of gastrointestinal stromal tumors in the imatinib (STI-571) era. Surgery 2003;134:656-665; discussion 665-666.
[50] Desai J, Shankar S, Heinrich MC, et al. Clonal evolution of resistance to imatinib (IM) in patients (pts) with gastrointestinal stromal tumor (GIST): molecular and radiologic evaluation of new lesions. Proc Am Soc Clin Oncol 2004;22:3010.
[51] Blay JY, Bonvalot S, Casali P, et al; GIST consensus meeting panelists. Consensus meeting for the management of gastrointestinal stromal tumors. Report of the GIST Consensus Conference of 20-21 March 2004, under the auspices of ESMO. Ann Oncol 2005;16:566-578.
[52] Antonescu CR, Besmer P, Guo T, et al. Acquired resistance to imatinib in gastrointestinal stromal tumor occurs through secondary gene mutation. Clin Cancer Res 2005;11:4182-4190.
[53] Debiec-Rychter M, Cools J, Dumez H, et al. Mechanisms of resistance to imatinib mesylate in gastrointestinal stromal tumors and activity of the PKC412 inhibitor against imatinib-resistant mutants. Gastroenterology 2005;128:270-79.
[54] Corless CL, Fletcher JA, Heinrich MC. Biology of gastrointestinal stromal tumors. J Clin Oncol 2004;22:3813-3825.
[55] Growney JD, Clark JJ, Adelsperger J, et al. Activation mutations of human c-KIT resistant to imatinib mesylate are sensitive to the tyrosine kinase inhibitor PKC412. Blood 2005;106:721-724.
[56] Tamborini E, Gabanti E, Lagonigro MS, et al. KIT/Val654 Ala receptor detected in one imatinib-resistant GIST patient. Cancer Res 2005;65:1115; author reply 1115.
[57] van Oosterom AT, Dumez H, Desai J, et al. Combination signal transduction inhibition: a phase I/II trial of the oral mTOR-inhibitor everolimus (E, RAD001) and imatinib mesylate (IM) in patients (pts) with gastrointestinal stromal tumor (GIST) refractory to IM. Proc Am Soc Clin Oncol 2004;22:3002.
[58] Demetri GD, Desai J, Fletcher JA, et al. SU11248, a multi-targeted tyrosine kinase inhibitor, can overcome imatinib (IM) resistance caused by diverse genomic mechanisms in patients (pts) with metastatic gastrointestinal stromal tumor (GIST). Proc Am Soc Clin Oncol 2004;22:3001.
[59] Evans TRJ, Morgan JA, van den Abbeele AD, et al. Phase I dose-escalation study of the SRC and multi-kinase inhibitor BMS-354825 in patients (pts) with GIST and other solid tumors. Proc Am Soc Clin Oncol 2005;23:3034.
[60] Duensing A, Joseph NE, Medeiros F, et al. Protein Kinase C theta (PKCtheta) expression and constitutive activation in gastrointestinal stromal tumors (GISTs). Cancer Res 2004;64:5127-5131.
[61] van Glabbeke M, Verweij J, Casali PG, et al. Initial and late resistance to imatinib in advanced gastrointestinal stromal tumors are predicted by different prognostic factors: a European Organisation for Research and Treatment of Cancer-Italian Sarcoma Group-Australasian Gastrointestinal Trials Group study. J Clin Oncol 2005;23:5795-804.
[62] Blay JY, Berthaud P, Perol D, et al. Continuous vs intermittent imatinib treatment in advanced GIST after one year: A prospective randomized phase III trial of the French Sarcoma Group. Proc Am Soc Clin Oncol 2004;22:9006.
[63] Le Cesne A, Perol D, Ray-Coquard I, et al. Interruption of imatinib (IM) in GIST patients with advanced disease: Updated results of the prospective French Sarcoma Group randomized phase III trial on survival and quality of life. Proc Am Soc Clin Oncol 2005;23:9031.
Πίνακας 1. Ταξινόμηση κατηγοριών κινδύνου γαστρεντερικών στρωματικών όγκων, βασισμένη στο μέγεθος, μιτοτικό δείκτη και ανατομική τοποθεσία.
| Ομάδα | Μέγεθος (εκ) | Mιτόσεις (HPF) | Κατηγορία κινδύνου |
| 1 | ≤2 | ≤5/50 |
Στόμαχος: καλοήθης Δωδεκαδάκτυλος: καλοήθης |
| 2 | 2-5 | ≤5/50 |
Στόμαχος: πολύ χαμηλό δυναμικό κακοήθειας Δωδεκαδάκτυλος: χαμηλό δυναμικό κακοήθειας |
| 3a | 5-10 | ≤5/50 |
Στόμαχος: πολύ χαμηλό δυναμικό κακοήθειας Δωδεκαδάκτυλος: δυναμικό κακοήθειας |
| 3b | >10 | ≤5/50 |
Στόμαχος: χαμηλό-μέσο δυναμικό κακοήθειας Δωδεκαδάκτυλος: δυναμικό κακοήθειας |
| 4 | ≤2 | >5/50 |
Στόμαχος: αβέβαιο Δωδεκαδάκτυλος: δυναμικό κακοήθειας |
| 5 | 2-5 | >5/50 |
Στόμαχος: χαμηλό-μέσο δυναμικό κακοήθειας Δωδεκαδάκτυλος: δυναμικό κακοήθειας |
| 6a | >5 | >5/50 | Στόμαχος: δυναμικό κακοήθειας |
| 6b | >10 | >5/50 | Δωδεκαδάκτυλος: δυναμικό κακοήθειας |
HPF = high power field
Πίνακας 2. Χειρουργικές πρακτικές της διαχείρισης των γαστρεντερικών στρωματικών όγκων.
|
Πίνακας 3. Ο ρόλος του χειρουργού στον γαστρεντερικό στρωματικό όγκο.
Πρωτογενής γαστρεντερικός στρωματικός όγκος
|
Χειρουργείο, συμπληρωματική θεραπεία ιματινίμπης Ιματινίμπη Ιματινίμπη |
Μεταστατικός γαστρεντερικός στρωματικός όγκος
|
Χειρουργείο; Χειρουργείο; |
Πίνακας 4. Διαφορετικοί μηχανισμοί αντίστασης στην ιματινίμπη μπορούν να προβλεφθούν από διαφορετικούς προγνωστικούς παράγοντες.
|