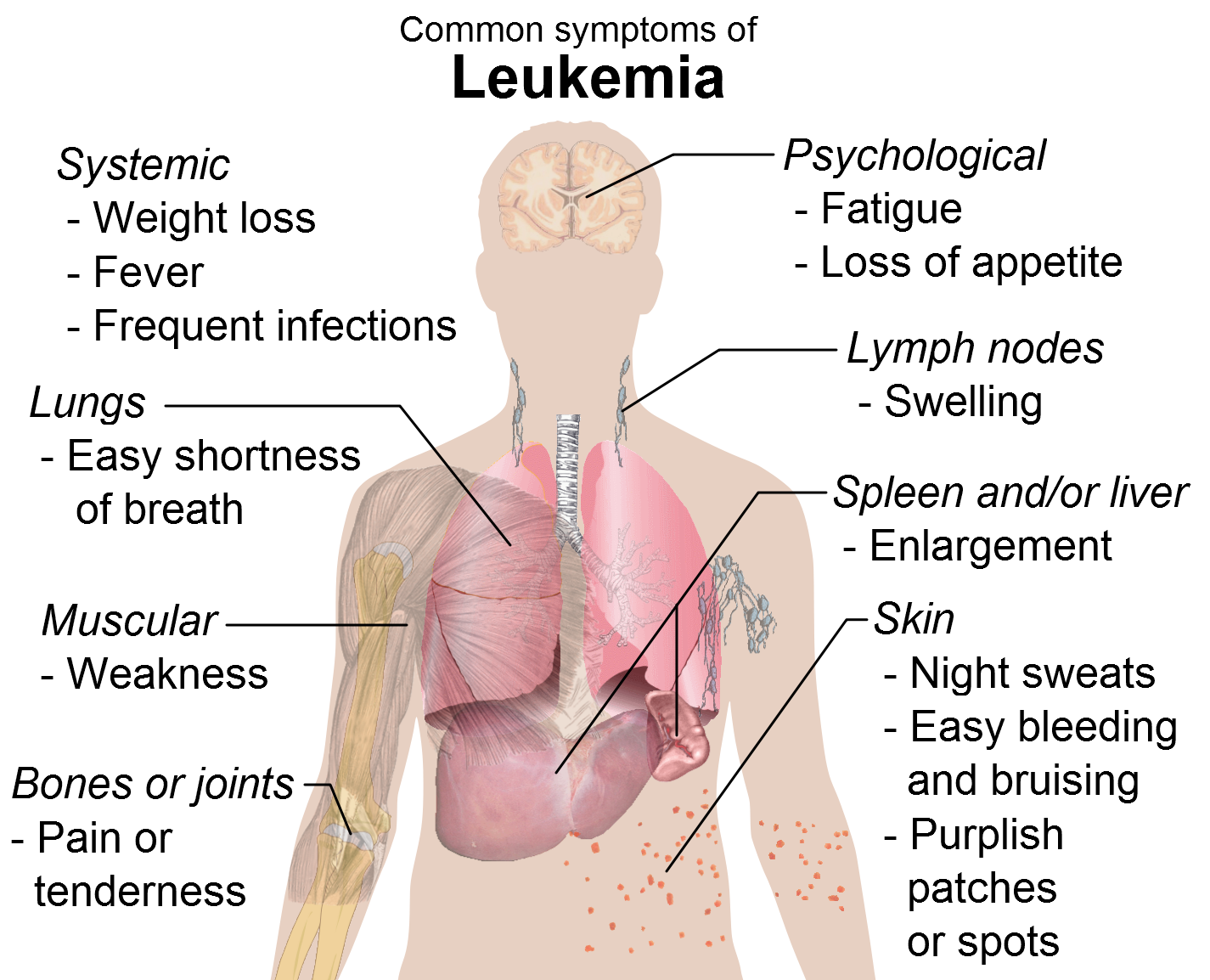
Ο FDA ενέκρινε το Venetoclax της AbbVie

Ο FDA ενέκρινε το Venetoclax της AbbVie για τη θεραπεία ασθενών με υποτροπιάζουσα/ανθεκτική Χρόνια Λεμφοκυτταρική Λευχαιμία με έλλειψη στο χρωμόσωμα 17p.
Η βιοφαρμακευτική εταιρεία AbbVie ανακοίνωσε ότι ο Οργανισμός Τροφίμων και Φαρμάκων των ΗΠΑ (FDA) ενέκρινε μέσω διαδικασίας ταχείας αξιολόγησης το venetoclax, σε μορφή δισκίων, για τη θεραπεία ασθενών με χρόνια λεμφοκυτταρική λευχαιμία (ΧΛΛ) με έλλειψη στο χρωμόσωμα 17p, όπως αυτή ανιχνεύεται με εγκεκριμένο από τον FDA τεστ και οι οποίοι έχουν λάβει τουλάχιστον μία θεραπεία στο παρελθόν.1
Ο FDA ενέκρινε την εν λόγω ένδειξη της θεραπείας στο πλαίσιο διαδικασίας ταχείας αξιολόγησης βάσει του συνολικού ποσοστού ανταπόκρισης, ενώ η διατήρηση της έγκρισης ενδέχεται να εξαρτηθεί από την επαλήθευση και την περιγραφή του κλινικού οφέλους στο πλαίσιο μελέτης επιβεβαίωσης. O FDA ενέκρινε το venetoclax ως θεραπεία με νέο μηχανισμό δράσης, την πρώτη στη κατηγορία αυτή (first-in-class), η οποία αναστέλλει εκλεκτικά τη λειτουργία της πρωτεΐνης BCL-21, χορηγούμενη από του στόματος μία φορά ημερησίως1.
Η πρωτεΐνη BCL-2 αποτρέπει την απόπτωση των κυττάρων (προγραμματισμένος κυτταρικός θάνατος), συμπεριλαμβανομένων ορισμένων καρκινικών κυττάρων, και μπορεί να υπερεκφράζεται στα κύτταρα της ΧΛΛ.1 Το venetoclax αναπτύσσεται από την AbbVie και την Genentech, εταιρεία-μέλος του Ομίλου Roche. Εκτός των ΗΠΑ διατίθεται στην αγορά από την AbbVie, ενώ στις ΗΠΑ διατίθεται και από τις δύο εταιρείες.
«Η έγκριση του venetoclax από τον FDA αποτελεί ορόσημο για την εταιρεία μας, πρωτίστως όμως για τους ασθενείς με υποτροπιάζουσα/ανθεκτική ΧΛΛ και έλλειψη στο χρωμόσωμα 17p», ανέφερε σε σχετική δήλωσή του ο Richard Gonzalez, Πρόεδρος του Διοικητικού Συμβουλίου και Διευθύνων Σύμβουλος της AbbVie. «Η αναστολή της πρωτεΐνης BCL-2 αποτελεί έναν καινοτόμο μηχανισμό, ο οποίος προσφέρει μια νέα θεραπευτική επιλογή στους ασθενείς που χρήζουν περαιτέρω θεραπείας».
«Τα αποτελέσματα από το πρόγραμμα κλινικών μελετών δείχνουν ότι το venetoclax επιτυγχάνει σημαντικό συνολικό ποσοστό ανταπόκρισης σε ασθενείς με ΧΛΛ που έχουν έλλειψη στο χρωμόσωμα 17p και έχουν λάβει προηγούμενη θεραπεία», δήλωσε ο Matthew S. Davids, M.D., M.MSc., Iατρός στο Ινστιτούτο κατά του Καρκίνου “Dana-Farber”, Επίκουρος Καθηγητής στην Ιατρική Σχολή του Πανεπιστημίου του Harvard και κύριος κλινικός ερευνητής του προγράμματος κλινικών μελετών του venetoclax. «Βάσει του προφίλ αποτελεσματικότητας και ασφάλειας που παρατηρήθηκε κατά τη διενέργεια των κλινικών μελετών, το venetoclax μπορεί να αποτελέσει ένα νέο σημαντικό και μοναδικό όπλο κατά της υποτροπιάζουσας/ανθεκτικής ΧΛΛ με έλλειψη στο χρωμόσωμα 17p».
«Η έγκριση του venetoclax ως αναστολέα της πρωτεΐνης BCL-2 (πρώτη θεραπεία με αυτό το μηχανισμό δράσης) προσφέρει στους γιατρούς μια σημαντική επιλογή για τη θεραπεία των ασθενών με υποτροπιάζουσα/ανθεκτική ΧΛΛ με έλλειψη στο χρωμόσωμα 17p», σχολίασε ο Michael Severino, M.D., Εκτελεστικός Αντιπρόεδρος Έρευνας και Ανάπτυξης και Επικεφαλής Επιστημονικού Τμήματος της AbbVie. «Με βάση την αποτελεσματικότητα που παρατηρήθηκε στον εν λόγω πληθυσμό ασθενών, το venetoclax έχει τη δυνατότητα να αποτελέσει μια σημαντική νέα θεραπεία, που θα δώσει ώθηση στις προσπάθειές μας να εισάγουμε καινοτόμες θεραπευτικές επιλογές για τους ασθενείς που πάσχουν από τη συγκεκριμένη μορφή καρκίνου».
Η ΧΛΛ είναι, κατά κανόνα, ένας βραδείας εξέλιξης καρκίνος του μυελού των οστών και του αίματος, όπου ένα είδος λευκών αιμοσφαιρίων που ονομάζονται λεμφοκύτταρα μετατρέπονται σε καρκινικά κύτταρα και πολλαπλασιάζονται ανεξέλεγκτα.2 Έλλειψη του 17p παρουσιάζει το 3-10% των ασθενών που δεν έχουν λάβει θεραπεία στο παρελθόν, και το 30-50% των ασθενών με υποτροπιάζουσα/ανθεκτική ΧΛΛ.3 Η έλλειψη του 17p είναι μια γονιδιωματική αλλοίωση, κατά την οποία ένα τμήμα του χρωμοσώματος 17 απουσιάζει.2,3 Οι ασθενείς με ΧΛΛ με έλλειψη του 17p έχουν κατά κανόνα δυσμενή πρόγνωση και προσδόκιμο επιβίωσης λιγότερο από 2-3 έτη.3,4
Στις αρχές του έτους, η AbbVie ανακοίνωσε ότι ο FDA ενέκρινε την αξιολόγηση κατά προτεραιότητα (priority review) της αίτησης νέου φαρμάκου για το venetoclax ως μονοθεραπεία.5 Ο ίδιος οργανισμός έδωσε επίσης τρεις φορές τον χαρακτηρισμό πρωτοποριακής θεραπείας (Breakthrough Therapy Designation) στο venetoclax –τον πρώτο για τη θεραπεία ασθενών με υποτροπιάζουσα/ ανθεκτική ΧΛΛ με έλλειψη του χρωμοσώματος 17p,6 το δεύτερο σε συνδυασμό με ριτουξιμάμπη για τη θεραπεία ασθενών με υποτροπιάζουσα/ανθεκτική ΧΛΛ,7 και τον τρίτο για πρώτη θεραπεία σε συνδυασμό με υπομεθυλιωτικούς παράγοντες, σε ασθενείς με οξεία μυελογενή λευχαιμία (ΟΜΛ), που δεν πληρούν τα κριτήρια χορήγησης συμβατικής θεραπείας εφόδου (υψηλής δόσης χημειοθεραπεία).8 Σύμφωνα με τον FDA, ο χαρακτηρισμός πρωτοποριακής θεραπείας αποσκοπεί στην επίσπευση της ανάπτυξης και της αξιολόγησης θεραπειών οι οποίες αφορούν σοβαρές ή απειλητικές για τη ζωή παθήσεις.9 Επιπλέον, πρόσφατα η AbbVie ανακοίνωσε επίσης ότι ο Ευρωπαϊκός Οργανισμός Φαρμάκων (EMA) ενέκρινε την αίτηση για χορήγηση άδειας κυκλοφορίας στο venetoclax για τη θεραπεία ασθενών με χρόνια λεμφοκυτταρική λευχαιμία (ΧΛΛ) με έλλειψη στο χρωμόσωμα 17p ή μετάλλαξη του TP53.10
Το πρόγραμμα κλινικών μελετών του venetoclax
Η ασφάλεια και η αποτελεσματικότητα του venetoclax στη ΧΛΛ με έλλειψη στο χρωμόσωμα 17p αξιολογήθηκαν σε μια ανοικτή, πολυκεντρική κλινική μελέτη 106 ασθενών, οι οποίοι είχαν λάβει άλλη θεραπεία στο παρελθόν. Το δοσολογικό σχήμα του venetoclax στους ασθενείς ήταν μία φορά ημερησίως με δόση εκκίνησης τα 20 mg, εβδομαδιαίως κλιμακούμενη στα 50 mg, τα 100 mg, τα 200 mg και τέλος τα 400 mg. Οι ασθενείς συνέχισαν να λαμβάνουν 400 mg του venetoclax άπαξ ημερησίως έως την εξέλιξη της νόσου ή την εμφάνιση μη αποδεκτής τοξικότητας. Το κύριο καταληκτικό σημείο αποτελεσματικότητας, το συνολικό ποσοστό ανταπόκρισης (ORR), ήταν 80%. Η ασφάλεια της μονοθεραπείας με venetoclax βασίζεται σε συγκεντρωτικά δεδομένα1 από δύο μελέτες φάσης 2 και μία μελέτη φάσης 1 σε 240 ασθενείς με ΧΛΛ που είχαν λάβει προηγουμένως άλλη θεραπεία. Οι πιο συχνές ανεπιθύμητες ενέργειες (≥20%) ήταν ουδετεροπενία (χαμηλές τιμές λευκών αιμοσφαιρίων), διάρροια, ναυτία, χαμηλές τιμές ερυθρών αιμοσφαιρίων, λοίμωξη του ανώτερου αναπνευστικού συστήματος, θρομβοπενία (χαμηλές τιμές πολυμορφοπύρηνων λευκών αιμοσφαιρίων) και κόπωση. Σοβαρές ανεπιθύμητες ενέργειες αναφέρθηκαν στο 43,8% των ασθενών. Οι πιο συχνές σοβαρές ανεπιθύμητες ενέργειες (≥2%) ήταν πνευμονία, χαμηλές τιμές λευκών αιμοσφαιρίων με πυρετό (εμπύρετη ουδετεροπενία), πυρετός, χαμηλές τιμές πολυμορφοπύρηνων ερυθρών αιμοσφαιρίων συνεπεία ανώμαλης διάσπασής τους (αυτοάνοση αιμολυτική αναιμία-ΑΑΑ), χαμηλές τιμές ερυθρών αιμοσφαιρίων και σύνδρομο λύσης όγκου (ΣΛΟ) 1.
Σχετικά με το venetoclax
Το venetoclax είναι ένας από του στόματος αναστολέας της πρωτεΐνης BCL-2, ο οποίος εγκρίθηκε από τον FDA στις ΗΠΑ για τη θεραπεία ασθενών με υποτροπιάζουσα/ανθεκτική ΧΛΛ με έλλειψη στο χρωμόσωμα 17p, όπως αυτή ανιχνεύεται σε τεστ εγκεκριμένο από τον FDA.1 Η πρωτεΐνη BCL-2 αποτρέπει την απόπτωση ορισμένων κυττάρων (προγραμματισμένος κυτταρικός θάνατος), συμπεριλαμβανομένων των λεμφοκυττάρων, και μπορεί να υπερεκφράζεται στα κύτταρα της ΧΛΛ.1 Το venetoclax είναι σχεδιασμένο να αναστέλλει εκλεκτικά τη λειτουργία της πρωτεΐνης BCL-2.1 Το venetoclax αναπτύχθηκε σε συνεργασία με την Genentech και την Roche. Οι εταιρείες έχουν αφοσιωθεί από κοινού στην έρευνα της BCL-2 με το venetoclax, το οποίο αξιολογείται επί του παρόντος σε κλινικές μελέτες φάσης 3 για τη θεραπεία της υποτροπιάζουσας/ανθεκτικής ΧΛΛ, μαζί με μελέτες πρώιμης φάσης για πολλές άλλες μορφές καρκίνου. Εκτός των ΗΠΑ διατίθεται στην αγορά από την AbbVie, ενώ στις ΗΠΑ διατίθεται και από τις δύο εταιρείες.
Σχετικά με την AbbVie
Η AbbVie είναι μία παγκόσμια βιοφαρμακευτική εταιρεία, η οποία δημιουργήθηκε το 2013 μετά από το διαχωρισμό της από την Abbott Laboratories. Αποστολή της εταιρείας είναι να αξιοποιήσει την εμπειρία της, τους αφοσιωμένους ανθρώπους της και τη μοναδική προσέγγισή της για καινοτομία, με σκοπό την ανάπτυξη προηγμένων θεραπειών που θα καλύπτουν μερικές από τις πιο σύνθετες και σοβαρές ασθένειες του κόσμου. Μετά και την εξαγορά της Pharmacyclics, η AbbVie σε παγκόσμιο επίπεδο απασχολεί πλέον περίπου 28.000 εργαζομένους (115 εκ των οποίων στην Ελλάδα) και δραστηριοποιείται σε περισσότερες από 170 χώρες. Για επιπλέον πληροφορίες παρακαλούμε επισκεφθείτε το www.abbvie.gr
Παραπομπές:
1 Venetoclax Prescribing Information AbbVie Inc & Genentech Inc: April 2016
2 American Cancer Society (2015). Leukemia – Chronic Lymphocyctic. http://www.cancer.org/acs/groups/cid/ documents/webcontent/003111-pdf.pdf. Ημ/νία προσπέλασης: 18 Ιανουαρίου 2016.
3 Schnaiter A. et al. 17p deletion in chronic lymphocytic leukemia: risk stratification and therapeutic approach. Hematol Oncol Clin N Am. 2013;27:289–301.
4.Stilgenbauer S. et al. Understanding and managing ultra high-risk chronic lymphocytic leukemia. Hematology Am Soc Hematol Educ Program. 2010(1):481-488.
5 Farrell A. Filing Communication (Priority). Department of Health and Human Services. 2015: 1-5.
6 Farrell A. Grant-Breakthrough Therapy Designation (17p del CLL). Department of Health and Human Services. 2015: 1-3.
7 Farrell A. Grant–Breakthrough Therapy Designation (CLL). Department of Health and Human Services. 2016: 1-3.
8 Farrell A. Grant–Breakthrough Therapy Designation (AML). Department of Health and Human Services. 2016: 1-3.
9 U.S. Food and Drug Administration (2015). Frequently Asked Questions: Breakthrough Therapies. http://www.fda.gov/regulatoryinformation/legislation/significantamendmentstothefdcact/fdasia/ucm341027.htm. Ημ/νία προσπέλασης: 15 Μαρτίου 2016.
10 Kozarewicz P. EMEA/H/C/004106/000. European Medicines Agency. 2015: 1-2.