Ατελής οστεογένεση: ΄Ενα όχι και τοσο σπάνιο νόσημα
Η ατελής οστεογένεση (osteogenesis imperfecta-Α.Ο) αποτελεί γενετικά καθοριζόμενη νόσο, η οποία χαρακτηρίζεται από αυξημένη ευθραυστότητα των οστών, ελαττωμένη οστική μάζα και από εμφάνιση καταγμάτων, ακόμα και κατά την ενδομήτρια ζωή.
Οι εξωσκελετικές εκδηλώσεις της νόσου περιλαμβάνουν: μπλε σκληρούς, ατελή οδοντογένεση, χαλαρότητα των αρθρώσεων και δέρματος, διαταραχή της ακοής, υπεριδρωσία, παρουσία βορμιανών οσταρίων και διαταραχές της ανάπτυξης.
Η πρώτη προσπάθεια ταξινόμησης έγινε από τους Sillence και συν.(1979) σε τέσσερις κλινικές κατηγορίες (τύποι Ι, ΙΙ, ΙΙΙ, IV). Στη συνέχεια, οι Glorieux και συν. (2002) περιέγραψαν τρεις επιπρόσθετες κλινικές κατηγορίες (τύποι V, VI , VII).
Η Α.Ο. τύπου V χαρακτηρίζεται από την παρουσία θετικού οικογενειακού ιστορικού οστικής ευθραστότητας και στις περισσότερες περιπτώσεις αυτοσωματικά επικρατούντα χαρακτήρα κληρονομικότητας, με τουλάχιστον ένα επεισόδιο σχηματισμού τύλου (60% των ασθενών ), περιορισμό στον πρηνισμό/υπτιασμό του ενός ή/και των δυο άνω άκρων, ενώ ακτινολογικά χαρακτηρίζεται από ασβεστοποίηση της μεσόστεας μεμβράνης, ανωμαλίες των σπονδύλων (ως σταθερά ευρήματα), παρουσία τυλώδους σχηματισμού, σχηματισμό βορμιανών οσταρίων και εξάρθρωσης της κεφαλής της κερκίδας.
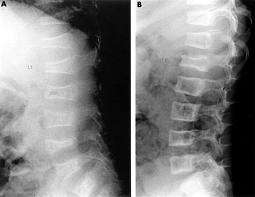
Η Α.Ο. τύπου VI (διαταραχή της μετάλλωσης του οστού) χαρακτηρίζεται από την παρουσία συμπιεστικών καταγμάτων πλευρών, χαμηλή οστική πυκνότητα οσφυϊκής περιοχής, αύξηση της αλκαλικής φωσφατάσης ορού (παρόμοια με την ALP των ασθενών-ίδιας ηλικίας-με Α.Ο τύπου IV), ενώ οι άλλοι βιοχημικοί δείκτες είναι στα φυσιολογικά όρια και στη μαγνητική απεικόνιση (MRI) των πασχόντων άνω ή/και κάτω άκρων παρατηρείται ραιβότητα και-συνήθως-πρόπτωση της κοτύλης.
Η Α.Ο. τύπου VII χαρακτηρίζεται από την παρουσία καταγμάτων ήδη από τη γέννηση, μπλε σκληρούς, πρώιμη παραμόρφωση των κάτω άκρων, ραιβά ισχία και οστεοπενία. Η ριζομελία (rhizomelia) αποτελεί σταθερό εύρημα. Η νόσος εντοπίζεται στο χρωμόσωμα 3p22-24.1, περιοχή που είναι εκτός των τυπικών για του τύπου I κολλαγόνου γονίδια.
Στις περισσότερες περιπτώσεις ασθενών με ατελή οστεογένεση, υπάρχει μετάλλαξη σε ένα από τα δύο γονίδια που κωδικοποιούν τις α αλυσίδες [pro α1(I) και pro α2(I)] του κολλαγόνου τύπου I, COL1A1 και COL1A2, που βρίσκονται στα χρωμοσώματα 17 (17q21.31-q22.05) και 7 (7q22.1), αντίστοιχα. Το αποτέλεσμα των παραπάνω μεταλλάξεων είναι είτε η μειωμένη παραγωγή φυσιολογικού κολλαγόνου τύπου Ι (τύπος Ι Α.Ο.), είτε η σύνθεση παθολογικού κολλαγόνου τύπου Ι (τύποι ΙΙ , ΙΙΙ, IV Α.Ο.). Στους ασθενείς με Α.Ο. τύπου V, VI, VII δεν παρατηρούνται μεταλλάξεις που να σχετίζονται με τα γονίδια που κωδικοποιούν για το κολλαγόνο τύπου I. Η νόσος κληρονομείται με τον αυτοσωματικό επικρατούντα ή υπολειπόμενο χαρακτήρα με γονεϊκό μωσαϊκισμό.
Η διάγνωση είναι ξεκάθαρη σε κάθε θετικό οικογενειακό ιστορικό ή παρουσία κλινικών ευρημάτων (κατάγματα και εξωσκελετικές εκδηλώσεις).
Σε αμφίβολες περιπτώσεις, η διάγνωση τίθεται με βιοψία δέρματος και με DNA ανάλυση από λευκοκύτταρα περιφερικού αίματος. Αυτές οι χρωμοσωμικές εξετάσεις αποκαλύπτουν το 90% των περιπτώσεων, δεδομένου ότι η απουσία μεταλλάξεων για το κολλαγόνο τύπου Ι δεν αποκλείει τη νόσο.
Η διαφορική διάγνωση της Α.Ο. περιλαμβάνει:
Σύνδρομο Bruck.
Σύνδρομο οστεοπορωτικού ψευδογλοιώματος.
Πανοστική ινώδη δυσπλασία.
Ιδιοπαθή υπερφωσφατασία (νεανική νόσος Paget).
Υποφωσφατασία.
Σύνδρομο Cole-Carpenter.
Ιδιοπαθή νεανική οστεοπόρωση.
Εγχονδρομάτωση
Κακοποίηση.
Η θεραπευτική προσέγγιση των ασθενών με A.O. περιλαμβάνει φυσιοθεραπεία, ορθοπεδική χειρουργική υποστήριξη και αποκατάσταση, βελτιώνοντας την ποιότητα ζωής τους, χωρίς όμως να μεταβάλλεται η οστική ευθραυστότητα. Το κενό αυτό καλύπτει η φαρμακευτική αγωγή με τα διφωσφονικά. Στο παρελθόν έχουν γίνει διάφορες θεραπευτικές προσπάθειες με χορήγηση ορμονών (καλσιτονίνη, οιστρογόνα, ανδρογόνα, κορτιζόνη και θυροξίνη), βιταμινών (A,C,D), μεταλλικών στοιχείων (αργίλιο, ασβέστιο, φθόριο, μαγνήσιο, φωσφόρος και στρόντιο) χωρίς επιτυχία. Τα διφωσφονικά είναι συνθετικά ανάλογα του πυροφωσφορικού οξέως στα οποία ένα άτομο οξυγόνου έχει αντικατασταθεί με ένα άτονο άνθρακα (P-C-P), ενώ έχουν μεγάλο χρόνο ημίσειας ζωής. Παρεμβαίνουν στη μεταβολική οδό βιοσύνθεσης της χοληστερόλης των οστεοκλαστών, αναστέλλοντας τη λειτουργία τους, χωρίς να έχει πλήρως διελευκανθεί ο ρόλος τους. Οι δράσεις των διφωσφονικών είναι δυνατό να εξετασθούν σε 3 επίπεδα: ιστικό, κυτταρικό και μοριακό.
Σε ιστικό επίπεδο η δράση όλων των διφοσφωνικών φαίνεται να είναι η ίδια-η ελάττωση του οστικού μεταβολισμού, καθώς στο επίπεδο των μεμονωμένων μονάδων ανακατασκευής, μάλλον υπάρχει μια θετική ισορροπία: ο σχηματισμός υπερτερεί της απορρόφησης.
Στο κυτταρικό επίπεδο φαίνεται-για την ώρα- να υπάρχει μια γενικότερη συμφωνία, ότι ο τελικός στόχος της δράσης (άμεσος ή έμμεσος) των διφωσφονικών είναι ο οστεοκλάστης. Τα διφωσφονικά θα μπορούσαν να ελαττώσουν την οστεοκλαστική οστική απορρόφηση μέσω : α) της αναστολής της εμφάνισης των οστεοκλαστών στην οστική επιφάνεια β) της αναστολής της οστεοκλαστικής δραστηριότητας στην οστική επιφάνεια γ) της ελάττωσης του χρόνου ζωής των οστεοκλαστών και δ) του επηρεασμού διαλυτότητας του οστού (δηλ. του υποστρώματος).
Στο μοριακό επίπεδο φαίνεται ότι το τοπίο είναι αρκετά θολό. Έχουν αναπτυχθεί δύο βασικές θεωρίες : α) τα διφωσφονικά επιδρούν σε έναν επιφανειακό υποδοχέα και/ή β) τα διφωσφονικά ¨προσλαμβάνονται¨ από το οστικό κύτταρο, οπότε και αντιδρούν με κάποιο ένζυμο ή άλλο ενδοκυττάριο μόριο, επηρεάζοντας τον κυτταρικό μεταβολισμό .
Οι άμεσοι στόχοι της θεραπείας με τα διφωσφονικά είναι η μείωση της συχνότητας των καταγμάτων, η ανακούφιση από το χρόνιο άλγος και την κόπωση, η βελτίωση της κινητικότητας, η πρόληψη των παραμορφώσεων των μακρών οστών και σπονδύλων. Η χορήγησή τους επιφέρει πάχυνση του οστικού φλοιού, με αύξηση του αριθμού των οστεοδοκίδων, αύξηση της οστικής πυκνότητας και αύξηση του ύψους των σωμάτων των σπονδύλων.
Οι παρενέργειες της θεραπείας όπως έχουν περιγραφεί και παρατηρηθεί είναι:
1. Αντίδραση «δίκην γρίπης», κυρίως μετά την πρώτη έγχυση διφωσφονικών, η οποία περιλαμβάνει πυρετό, εξάνθημα, γαστρεντερικές διαταραχές, συνοδευόμενη από λεμφοπενία, αύξηση του TNFa, αύξηση της IL-6
2. Αύξηση βάρους σώματος, που μπορεί να οδηγήσει σε παχυσαρκία. Φαίνεται ότι τα διφωσφονικά έχουν επίδραση στην κατανάλωση ενέργειας, όπως διαπιστώνεται από την ελάττωση της εφίδρωσης, ενώ η μείωση του αριθμού των καταγμάτων και του πόνου αυξάνει την όρεξη.
3. Ραγοειδίτιδα.
4. Μικροασβεστοποίηση των νεφρικών θηλών.
5. Οστεοπέτρωση, ως δοσοεξαρτώμενο δυσμενές αποτέλεσμα.
Είναι σημαντικό να σημειωθεί η πρόσφατη έναρξη χρήσης των διφωσφονικών στη θεραπεία παιδιών με Α.Ο. κι έτσι δεν είναι εφικτό να προβλέψει κανείς τα απώτερα αποτελέσματα. Θεωρητικός κίνδυνος παραμένει η τερατογόνος δράση τους όταν χορηγούνται σε κορίτσια αναπαραγωγικής ηλικίας, λόγω της μακράς παραμονής του φαρμάκου στο σκελετό.
Ποιά κατηγορία ασθενών ωφελείται από τη χορήγηση των διφωσφονικών; Είναι προφανές ότι οι σοβαρές μορφές θα έχουν όφελος. Τι γίνεται όμως με τις ήπιες μορφές (λιγότερο από δύο κατάγματα το χρόνο, κανένα σπονδυλικό κάταγμα και καμία παραμόρφωση); Θα πρέπει με τη χορήγησή τους να εξασφαλίζεται το μέγιστο των πλεονεκτημάτων τους και να διατηρούνται στο ελάχιστο οι δυνητικές τους παρενέργειες. Επομένως, χρειάζεται συνεχής και συστηματική προσπάθεια και διεξαγωγή ελεγχόμενων πολυκεντρικών μελετών. Τονίζεται ότι τα διφωσφονικά δεν μεταβάλλουν το γενετικό υπόστρωμα της ατελούς οστεογένεσης και επομένως η εφαρμογή τους αποτελεί συμπτωματική θεραπεία.
Η επίδραση της αυξητικής ορμόνης σε συνδυασμό με τα διφωσφονικά, καθώς και η χορήγηση του συνθετικού Ν-τελικού τμήματος της παραθορμόνης [rhPTH(1-34):τεριπαρατίδη] θα πρέπει να εξετασθούν σε ελεγχόμενα προγράμματα κλινικής εφαρμογής, έτσι ώστε η ερμηνεία των αποτελεσμάτων των μελετών να είναι στατιστικά ισχυρή. Σημειώνεται η εμφάνιση οστεοσαρκώματος σε αρουραίους οι οποίοι έλαβαν μεγάλες δόσεις τεριπαρατίδης από μικρή ηλικία. Σε πειραματικό επίπεδο παραμένουν η μεταμόσχευση μεσεγχυματικών κυττάρων καθώς και η παρεμβολή με ριβοένζυμα ιών στα μεταλλαγμένα γονίδια.
Σημαντικό χώρο μελέτης αποτελεί και ο μεταβολισμός του συνδετικού ιστού. Το πεδίο των βιοχημικών οστικών δεικτών εξελίσσεται ραγδαία με την ανάπτυξη μεθόδων προσδιορισμού μεγαλύτερης ευαισθησίας και ειδικότητας, όπως επίσης και οι κλινικές εφαρμογές τους στην εκτίμηση της οστικής μάζας.
Οι δείκτες οστικής παραγωγής:
– αλκαλική φωσφατάση (t-ALP)
– οστικό κλάσμα αλκαλικής φωσφατάσης (b-ALP)
– οστεοκαλσίνη (Oc)
– N-τελικό προπεπτίδιο προκολλαγόνου τύπου Ι (ΡΙΝΡ)
– C-τελικό προπεπτίδιο προκολλαγόνου τύπου Ι (PICP) και
οι δείκτες οστικής απορρόφησης:
– ανθεκτικό στο τρυγικό άλας κλάσμα της όξινης φωσφατάσης (TRAP 5b)
– C-τελικό τελοπεπτίδιο προκολλαγόνου τύπου Ι (ICTP)
– υδροξυπρολίνη (ΗYP)
– πυριδινολίνη (PYR) και δεοξυπυριδινολίνη (DPYR)
– Ν-τελοπεπτίδιο πολυμερών κολλαγόνου τύπου Ι (ΝΤΧ)
– C-τελοπεπτίδιο πολυμερών κολλαγόνου τύπου Ι (CTX)
δυνητικά μπορούν να χρησιμοποιηθούν για την παρακολούθηση ασθενών με ατελή οστεογένεση.
Βασικό ρόλο στη βιολογία των οστεοκλαστών διαδραματίζει κι ένα σύστημα κυτοκινών: ο παράγοντας νέκρωσης όγκου TNF-like ligand, οι ιντερλευκίνες (IL-1 IL-6, IL-15), ο ενεργοποιητής του υποδοχέα του πυρηνικού παράγοντα (NF)-κB (RANKL), ο υποδοχέας του (RANK) και ο διαλυτός decoy (δόλωμα) υποδοχέας οστεοπροτεγερίνη (OPG).
Ο άξονας RANKL/RANK/OPG αποτελεί ρυθμιστικό σύστημα της ωρίμανσης, διαφοροποίησης, επιβίωσης, δραστηριοποίησης και απόπτωσης των οστεοκλαστών.
Εργαστηριακοί δείκτες οι οποίοι θα μπορούσαν μελλοντικά να συμβάλουν στην παρακολούθηση της φυσιολογικής ρύθμισης του οστικού μεταβολισμού και της παθογένεσης σκελετικών νόσων, είναι οι :
-οστική σιαλοπρωτεΐνη (BSP)
-σύμπλεγμα α2 –μακροσφαιρίνη- α2-μικροσφαιρίνη
-advanced glycation end products(AGE)
-transforming growth factor (TGF)
-υδροξυλυσίνη ούρων
-IL-11