SARS-CoV-2 και μιτοχονδριακή υγεία: επιπτώσεις στον τρόπο ζωής και τη γήρανση
Η μόλυνση με SARs-COV-2 εμφανίζει αυξανόμενη θνησιμότητα σχετιζόμενη με την ηλικία και την υποκείμενη συννοσηρότητα, ιδίως, με δείκτες του μεταβολικού συνδρόμου και του διαβήτη, οι οποίοι φαίνεται να σχετίζονται με μια «καταιγίδα κυτοκίνης» και μια μεταβλητή ανοσοαπόκριση. Αυτό υποδηλώνει ότι ένας βασικός παράγοντας που συμβάλλει σε αυτό, θα μπορούσε να είναι η ανοσοαπόκριση που σχετίζεται τόσο με την ηλικία όσο και τον τρόπο ζωής.
Καθώς το ίδιο το ανοσοποιητικό σύστημα εξαρτάται σε μεγάλο βαθμό από τη μιτοχονδριακή λειτουργία, η διατήρηση ενός υγιούς μιτοχονδριακού συστήματος μπορεί να διαδραματίσει βασικό ρόλο στην αντίσταση κατά του ιού, τόσο άμεσα όσο και έμμεσα, διασφαλίζοντας έτσι και μια καλύτερη ανταπόκριση στο εμβόλιο. Επιπλέον, καθώς οι ιοί γενικά, και πιθανότατα αυτός ο νέος ιός, έχουν επίσης εξελιχθεί με τέτοιο τρόπο, ώστε να είναι ικανοί να ρυθμίσουν τον ανοσομεταβολισμό και την μιτοχονδριακή λειτουργία των κυττάρων που προσβάλλουν με σκοπό να διασφαλίσουν την αναπαραγωγή τους, αυτό θα μπορούσε να προκαλέσει περαιτέρω στρες στην κυτταρική βιοενέργεια. Σε αντίθεση με τους περισσότερους σύγχρονους ανθρώπους που έχουν ένα καθιστικό τρόπο ζωής, ένας από τους φυσικούς ξενιστές του ιού, η νυχτερίδα, πρέπει να «ασκείται» τακτικά για να βρει τροφή, η οποία παρέχει συνεχώς ένα ισχυρό προσαρμοστικό ερέθισμα για τη διατήρηση των λειτουργικών μυών και των μιτοχονδρίων.
Στην πραγματικότητα, η νυχτερίδα εκτίθεται σε τακτικά ορμονικά ερεθίσματα, τα οποία θα μπορούσαν να δώσουν ενδείξεις για το πώς να αντισταθεί σε αυτόν τον ιό.
Σε αυτό το άρθρο εξετάζουμε τα δεδομένα που μπορεί να υποστηρίξουν την ιδέα ότι η μιτοχονδριακή υγεία, που κατακτάται από έναν υγιεινό τρόπο ζωής, θα μπορούσε να αποτελέσει βασικό παράγοντα κατά του ιού και για εκείνους τους ανθρώπους που ίσως δεν είναι σε βέλτιστη υγεία, ενώ θεραπείες που θα μπορούσαν να υποστηρίξουν τη μιτοχονδριακή λειτουργία μπορεί να είναι καθοριστικής σημασίας για τη μακροπρόθεσμη ανάκαμψή τους.
1. Εισαγωγή
Ο κίνδυνος σοβαρής νοσηρότητας που σχετίζεται με λοίμωξη από τον SARS-CoV-2 αυξάνεται με την ηλικία και τις υποκείμενες συννοσηρότητες, που υποδηλώνουν ότι έως 1,7 δισεκατομμύρια άνθρωποι, ή το 22% του παγκόσμιου πληθυσμού, μπορεί να διατρέχουν σοβαρό κίνδυνο.
Ο αυξημένος κίνδυνος φαίνεται να σχετίζεται σε μεγάλο βαθμό με μια μη ισορροπημένη ή /και την υπερβολική φλεγμονώδη απόκριση [1]. Μία υπόθεση είναι ότι, η σοβαρότητα της νόσου θα μπορούσε να σχετίζεται με την αποτυχία της επίλυσης της φλεγμονής, που οδηγεί σε πνευμονική υπερ-φλεγμονή και «καταιγίδες κυτοκίνης» [2].
Με την αύξηση της ηλικίας υπάρχει συχνά υπερβολική έμφυτη ανοσοαπόκριση στις αναπνευστικές λοιμώξεις [3] και αυξανόμενος φλεγμονώδης τόνος [4,5]. Συνολικά, φαίνεται ότι η ευαισθησία στον ιό σχετίζεται με απώλεια προσαρμοστικής ανοσίας που σχετίζεται με την ηλικία σε συνδυασμό με αυξημένη έμφυτη ανοσοαπόκριση [6].
Αυτή η «inflammaging» δηλαδή χρόνια φλεγμονή χαμηλής έντασης που σχετίζεται με την αύξηση της ηλικίας και τη δυσλειτουργική ανοσία, φαίνεται να σχετίζεται με την ανοσοαπόκριση των Τ-κυττάρων και τη θυμική ατροφία, ενώ επίσης φαίνεται να είναι προστατευτική η άσκηση [7].
Το προστατευτικό αποτέλεσμα της άσκησης είναι διακριτό, καθώς η παθολογική σοβαρότητα της λοίμωξης SARS-CoV-2 φαίνεται να σχετίζεται με πολλές σχετιζόμενες με την παχυσαρκία συννοσηρότητες, όπως ο διαβήτης [8, 9, 10], ενώ σε αντίθεση, εμφανίζεται η φυσική κατάσταση ως προληπτική στρατηγική κατά του ιού [11].
Αυτό υποδηλώνει ότι τόσο η ηλικία, όσο και ο τρόπος ζωής θα μπορούσε να είναι σημαντικός για τον προσδιορισμό της ευαισθησίας στον ιό. Έχουμε προτείνει ότι ένας σύγχρονος καθιστικός τρόπος ζωής έχει αφαιρέσει αποτελεσματικά τα εξωγενή ορμονικά ερεθίσματα, όπως η σωματική δραστηριότητα, η οποία οδηγεί σε επιταχυνόμενο φαινότυπο γήρανσης [12].
Εν ολίγοις, ένας σύγχρονος τρόπος ζωής θα μπορούσε να επιταχύνει τη διαδικασία «φλεγμονής»: η παχυσαρκία σχετίζεται με μια προ-φλεγμονώδη κατάσταση, αυξημένα φλεγμονώδη μακροφάγα και αλλοιωμένη ομοιόσταση Τ-κυττάρων [13]. Αντίθετα, η άσκηση είναι σε μεγάλο βαθμό αντιφλεγμονώδης, η οποία πιστεύεται ότι εξηγεί τα πολλά οφέλη της [14 ,15].
Ένας βασικός παράγοντας σε αυτήν την προσαρμογή είναι το μιτοχόνδριο, καθώς το μιτοχονδριακό στρες ενισχύει τη μιτοχονδριακή λειτουργία όχι μόνο στους μυς, αλλά και σε πολλά άλλα όργανα με τις μυοκίνες να παίζουν βασικό ρόλο [16,17].
Για παράδειγμα, η ιρισίνη, η οποία προστατεύει τα μιτοχόνδρια, μπορεί να προστατεύσει από ισχαιμία / επανέγχυση (IR) μετά από τραυματισμό του πνεύμονα [18]. Η ιρισίνη έχει επίσης βρεθεί ότι μεταβάλλει ευνοϊκά γονίδια σε λιποκύτταρα που επηρεάζονται από το SARS-CoV-2 [19] και ότι ρυθμίζει τις οξειδωτικές ρίζες οξυγόνου (ROS) στα μακροφάγα, εμφανίζοντας αντιοξειδωτικές και αντιφλεγμονώδεις ιδιότητες [20]. Επίσης, η άσκηση μπορεί να ενισχύσει τη μιτοχονδριακή λειτουργία και ικανότητα στα μονοπύρηνα κύτταρα του περιφερικού αίματος (PBMCs) [21].
Καθώς τα μιτοχόνδρια είναι καθοριστικής σημασίας για την ανοσοαπόκριση και πολλοί ιοί με τη σειρά τους επηρεάζουν τα μιτοχόνδρια [22, 23 ], είναι πιθανό η αλλοιωμένη μιτοχονδριακή λειτουργία να εξηγεί τουλάχιστον μέρος της διακύμανσης των αποκρίσεων στον SARS-CoV-2.
Καθώς όλα κύτταρα του σώματος περιέχουν μιτοχόνδρια, συμπεριλαμβανομένων των ανοσοκυττάρων, αυτό θα ήταν αναμενόμενο και κατά αυτό τον τρόπο εισάγεται η έννοια του «ανοσομεταβολισμού».
Αυτό φαίνεται πιο ξεκάθαρα στον κλινικό φαινότυπο ατόμων με κληρονομικά μιτοχονδριακά ελαττώματα που συχνά εμφανίζουν ανοσοανεπάρκεια και πολύ υψηλότερο ποσοστό λοιμώξεων – τονίζοντας την εξάρτηση του ανοσοποιητικού συστήματος από τα μιτοχόνδρια [24, 25].
Αν και αυτό σχετίζεται με την αντοχή στον ιό, είναι επίσης ίσως σχετικό με την αποτελεσματικότητα των εμβολίων. Ο Thacker και οι συνεργάτες του στην μελέτη τους έδειξαν ότι, χρησιμοποιώντας προσδιορισμούς γονιδιακής έκφρασης PBMCs, υπάρχει μια σχετική με την ηλικία μείωση της απόκρισης στα εμβόλια γρίπης, η οποία φαίνεται να συνδέεται με μειωμένη μιτοχονδριακή λειτουργία [26].
Εν ολίγοις, η μειωμένη μιτοχονδριακή λειτουργία, είτε λόγω γενετικών παραγόντων, ηλικίας ή τρόπου ζωής, θα μπορούσε να έχει αντίκτυπο τόσο στην αντίσταση στον ιό όσο και στην ικανότητα εμφάνισης αποτελεσματικής απόκρισης σε ένα εμβόλιο.
Φαίνεται λοιπόν ότι, η διατήρηση της «μιτοχονδριακής υγείας» είναι ζωτικής σημασίας. Αυτή πιθανά σχετίζεται με ένα αποτελεσματικό αποθεματικό μιτοχονδρίων που προκαλείται από παράγοντες όπως η σωματική δραστηριότητα, έτσι ώστε όταν το σύστημα «στρεσαριστεί» (π.χ. από έναν ιό),να μπορεί να τον αντιμετωπίσει.
Αν και ο ιός μπορεί να μολύνει μόνο ορισμένα κύτταρα, η ανοσοαπόκριση είναι συνολική και εξαρτάται από τη μιτοχονδριακή λειτουργία σε πολλούς ιστούς και όργανα. Αυτό που είναι σαφές είναι ότι η σοβαρότητα σχετίζεται με το σύνδρομο υπερφλεγμονής και συνεπάγεται δυσλειτουργία πολλών διαφορετικών τύπων κυττάρων [27].
Στην εξελικτική διαδικασία των ειδών, οι ιοί έχουν εξελιχθεί, όπως είναι αναμενόμενο, για να χειριστούν το ανοσοποιητικό σύστημα ώστε «να κρυφτούν» από αυτό, και να μπορούν να προκαλέσουν διαφοροποιημένη ανοσοανταπόκριση, η οποία από μόνη της μπορεί να γίνει παθολογική, για παράδειγμα, διαμορφώνοντας τα Τ-κύτταρα [28 ,29].
Φαίνεται τώρα ότι, η ακίδα πρωτεΐνης του SARS-CoV-2 μπορεί να δεσμευτεί σε υποδοχείς των Τ-κυττάρων (TCRs), ενεργώντας ως υπερ-αντιγόνο και προκαλώντας υπερβολική ενεργοποίηση του προσαρμοστικού ανοσοποιητικού συστήματος – πιθανώς με αποτέλεσμα το υπερφλεγμονώδες σύνδρομο [30].
Αυτό είναι ίσως σχετικό καθώς η επίμονη αντιγονική διέγερση μπορεί να οδηγήσει σε εξάντληση των κυττάρων Τ, η οποία σχετίζεται με μειωμένη οξειδωτική φωσφορυλίωση και απώλεια μιτοχονδριακής λειτουργίας παρά την αυξημένη γλυκόλυση – αλλά μπορεί να αντιστραφεί χρησιμοποιώντας αντιοξειδωτικά [31].
Τα δεδομένα δείχνουν τώρα ότι οι ασθενείς με COVID-19 έχουν πληθυσμούς Τ-κυττάρων που εμφανίζουν μιτοχονδριακή δυσλειτουργία, καθώς και αλλοιωμένους μιτοχονδριακούς δείκτες σε μονοκύτταρα – υπονοώντας ότι ο ανοσο-μεταβολικός φαινοτυπικός χαρακτήρας θα μπορούσε να χρησιμοποιηθεί για την κατανόηση της παθογένεσης και πιθανών θεραπειών.
Αυτό θα μπορούσε να περιλαμβάνει τη στόχευση των μιτοχονδρίων [32]. Εν ολίγοις, το ίδιο το ανοσοποιητικό σύστημα θα μπορούσε να είναι στόχος για αυτόν τον ιό. Εκτός από τον ιό που στοχεύει το TCR ως υπερ-αντιγόνο, υπάρχουν ενδείξεις ότι εκτός από το ότι συνδέεται με το ένζυμο μετατροπής της αγγειοτενσίνης (ACE) ως τον κύριο υποδοχέα του, μπορεί επίσης να δεσμεύει τους υποδοχείς σε ανοσοκύτταρα, όπως τα CD147 και CD26 [33] ή νευροπιλίνη-1 (Nrp-1) [34, 35].
Έχουμε δομήσει αυτό το άρθρο για να εξετάσουμε πρώτα τα πλέον καθιερωμένα δεδομένα σχετικά με τη γενική μιτοχονδριακή λειτουργία και την υγεία σε σχέση με την «φλεγμονή», ακολουθούμενη από τα στοιχεία που υποδηλώνουν ότι, ο ίδιος ο ιός SARS-CoV-2 χειρίζεται τη μιτοχονδριακή λειτουργία και τι μπορούμε να μάθουμε από τα νυχτερίδες που πιστεύεται ότι είναι ο φυσικός του ξενιστής.
Από αυτό προτείνουμε ότι ένας κακός τρόπος ζωής επιταχύνει την «φλεγμονή» που σχετίζεται με την μιτοχονδριακή κακή υγεία, και σε ορισμένους πληθυσμούς αυτό τους προδιαθέτει σε χειρότερο αποτέλεσμα.
Στο δεύτερο μέρος της εργασίας συζητάμε την επίπτωση αυτής της ιδέας σε σχέση με τις τρέχουσες και προτεινόμενες θεραπείες με βάση τα φάρμακα και την αποτελεσματικότητα του εμβολίου, το σύνδρομο «long-COVID», καθώς και πώς οι περιβαλλοντικοί παράγοντες μπορούν να κάνουν μερικούς ανθρώπους πιο ευάλωτους. Η κατανόηση αυτών των εννοιών μπορεί να βοηθήσει στην ενημέρωση της κλινικής στρατηγικής.
2. Η μιτοχονδριακή λειτουργία στη φλεγμονή και την ανοσοαπόκριση
Τα κυκλοφορούντα εξωκυτταρικά κυστίδια (EVs) που προέρχονται από ανοσοκύτταρα φαίνεται να έχουν προκύψει ως ένα μέσο μελέτης του ανοσοεκφυλισμού. Συγκεκριμένα, παρουσιάζουν μια μείωση της μιτοχονδριακής λειτουργίας που σχετίζεται με την ηλικία – η οποία θα μπορούσε να σχετίζεται με δυσλειτουργική μιτοφαγία [36] (καταστροφή των μιτοχνδρίων).
Στην πραγματικότητα, τα ποντίκια που έχουν σχεδιαστεί για να έχουν δυσλειτουργικά μιτοχόνδρια των Τ-κυττάρων εμφανίζουν επιταχυνόμενη γήρανση και «inflammaging» (υπερφλεγμονή), επισημαίνοντας ότι τα Τ-κύτταρα μπορούν να καθορίσουν την οργανική λειτουργικότητα και τη διάρκεια ζωής [37]. Αυτό υποστηρίζεται από τα δεδομένα που δείχνουν τη σημασία μιας υγιούς απόκρισης Τ-κυττάρων στην άμυνα κατά του ιού [38,39].
Η υποκείμενη αιτιολογία του «inflammaging» εδώ και αρκετό διάστημα καιρό, έχει συσχετιστεί με την μιτοχονδριακή δυσλειτουργία, όπως προτάθηκε από τον Nick Lane το 2003 στη θεωρία του «διπλού παράγοντα» [5], και τώρα λαμβάνει μεγαλύτερο ενδιαφέρον, για παράδειγμα, για το πώς μπορεί μειωμένη μιτοχονδριακή λειτουργία να μειώσει τη λειτουργία των Τ-κυττάρων ενισχύοντας την ανοσολογική γήρανση, καθώς τα μιτοχόνδρια είναι κεντρικής σημασίας στον μεταβολικό επαναπρογραμματισμό προς το φαινόμενο Warburg [40].
Πράγματι, καθώς η μιτοχονδριακή δυσλειτουργία μπορεί να οδηγήσει σε «inflammaging», η παρατηρούμενη αύξηση των ηλικιωμένων ατόμων στις μιτοκίνες θα μπορούσε να είναι μια προσπάθεια του συστήματος να αποκαταστήσει την ομοιόσταση, καθώς πολλά από αυτά είναι αντιφλεγμονώδη. Δυστυχώς, για πολλούς, αυτή η απάντηση δεν είναι πλήρως αποδεκτή [41]. Για αυτό φαίνεται να απαιτούνται «εξωγενείς» παράγοντες, όπως η σωματική δραστηριότητα ή ο περιορισμός των θερμίδων για τη βελτιστοποίηση της λειτουργίας που ήταν φυσιολογικοί παράγοντες κατά τη διάρκεια της εξέλιξης, αλλά όχι για το σύγχρονο καθιστικό και παχυγενές περιβάλλον μας.
Μία πτυχή της γήρανσης είναι η αποτυχία αφαίρεσης κατεστραμμένων συστατικών, για παράδειγμα, δυσλειτουργικών μιτοχονδρίων μέσω μιτοφαγίας, η οποία θα μπορούσε να οδηγήσει σε ανοσολογική δυσλειτουργία [42].
Έχει προταθεί ότι οι ανισορροπίες στη μιτοχονδριακή μάζα θα μπορούσαν να ευθύνονται για τη σχετιζόμενη με τη γήρανση δυσλειτουργία του υποσυνόλου των Τ-κυττάρων [43], η οποία υποδηλώνει αποτυχία της μιτοφαγίας.
Πράγματι, η ενεργοποίηση της μιτοφαγίας/αυτοφαγίας πιστεύεται ότι αποτελεί κεντρικό μηχανισμό για την επιβράδυνση της γήρανσης και την αναστολή της φλεγμονής κατά τον περιορισμό των θερμίδων (CR) [44]: Η CR / διαλειμματική νηστεία έχει προταθεί ως άμυνα ενάντια στον SARS-CoV-2 γιατί είναι αντιφλεγμονώδης [45].
Αντίθετα, παίζει βασικό ρόλο ο σύγχρονος καθιστικός τρόπος ζωής που συμβάλλει επίσης στην «inflammaging» η οποία δρα ως ένας κοινός μηχανισμός που συνδέει τη σαρκοπενία, την παχυσαρκία, την καρδιομυοπάθεια και τη δυσβίωση, με την υπερβολική ενεργοποίηση υποδοχέων τύπου nod NLRP3 και την μιτοχονδριακή δυσλειτουργία [46]. Συνολικά, όλα αυτά φαίνεται να υποστηρίζουν μια στενή σχέση μεταξύ ανοσοεκφυλισμού, «inflammaging» και μειωμένης μιτοχονδριακής λειτουργίας.
3. Ο SARS-CoV-2 ρυθμίζει τη μιτοχονδριακή λειτουργία, έμμεσα ή άμεσα, και εάν ναι, σε ποια κύτταρα;
Τα παραπάνω υποδηλώνουν ότι υπάρχει στενή σχέση μεταξύ της μιτοχονδριακής δυσλειτουργίας και της ανοσοεπίδρασης, η οποία θα μπορούσε να οδηγήσει σε αυξημένη πιθανότητα μη ισορροπημένης ανοσοαπόκρισης στον SARS-CoV-2.
Αυτό θα μπορούσε να λάβει τη μορφή τόσο της αδυναμίας καταπολέμισης του ιού, αλλά και μιας υπερβολικής υπερφλεγμονώδους απόκρισης και μιας «καταιγίδας κυτοκινών».
Ωστόσο, θα μπορούσε επίσης να υπάρχει ένας άλλος παράγοντας, και αυτός είναι ότι ο ιός ρυθμίζει τη μιτοχονδριακή λειτουργία για να τον βοηθήσει να αναπαραχθεί. Μια ένδειξη για αυτήν την πιθανότητα είναι ότι πολλοί ιοί φαίνεται να χειρίζονται τη βιοενέργεια για την αερόβια γλυκόλυση (το «φαινόμενο Warburg»).
Αυτή είναι μια διαδικασία ιδιαίτερα εξαρτώμενη ενεργειακά για να βοηθήσει την παραγωγή υποστρωμάτων για την κατασκευή νέων σωματιδίων του ιού [47]. Η αερόβια γλυκόλυση απαιτεί υγιή μιτοχόνδρια και είναι μια φυσιολογική διαδικασία σε πολλαπλούς κυτταρικούς τύπους, συμπεριλαμβανομένων των ανοσοκυττάρων [48].
Τα δεδομένα δείχνουν ότι η επιτυχής κλωνική επέκταση των Τ-κυττάρων που προκαλούνται από το εμβόλιο εξαρτάται σε μεγάλο βαθμό από τη μιτοχονδριακή λειτουργία [49]. Αυτό υποδηλώνει ότι κάθε κύτταρο που αναγκάζεται να παράγει νέους ιούς, εάν τα μιτοχόνδρια του δεν λειτουργούν βέλτιστα, θα μπορούσε να γίνει γρήγορα ενεργειακά ανεπαρκές και πιθανότερο να πεθάνει, και ανάλογα με τον τύπο και τη θέση του, θα μπορούσε είτε να ενισχύσει τη φλεγμονή και / ή να θέσει σε κίνδυνο την ανοσολογική απόκριση.
4. Ποιοι είναι οι υποδοχείς του SARS-CoV-2 και πού βρίσκονται;
Ο άμεσος αντίκτυπος του ιού θα εξαρτηθεί από τα κύτταρα που μολύνει. Μέχρι σήμερα, τα περισσότερα στοιχεία δείχνουν ότι το ACE2 είναι ο κύριος υποδοχέας αυτού του ιού.
Τα πρώιμα δεδομένα που υποδηλώνουν ότι το ACE2 εκφράζεται κυρίως σε πνευμονικούς κυψελιδικούς προγόνους τύπου 2 (ΑΤ2) και στα αναπνευστικά επιθηλιακά κύτταρα, αλλά εκφράζεται επίσης σε μυοκαρδιακό, ιλιίο (illium) και στον οισοφάγο, καθώς και σε ορισμένα νεφρικά κύτταρα – με μικρή έκφραση στα ανοσοκύτταρα [50]. Αυξημένη έκφραση ACE2 έχει επίσης βρεθεί στο οσφρητικό νευροεπιθήλιο, εξηγώντας δυνητικά την ανοσμία που εμφάνισαν μερικοί ασθενείς [51]. Πιο πρόσφατα δεδομένα έχουν δείξει ότι το ACE2 μπορεί να εκφράζεται πρωτίστως σε βρογχικά εκκριτικά κύτταρα [52].
Ίσως ο αυξημένος κίνδυνος που σχετίζεται με την παχυσαρκία είναι ότι, έχει βρεθεί υψηλή έκφραση ACE2 τόσο στον σπλαχνικό όσο και στον υποδόριο λιπώδη ιστό. Αυτό είναι σημαντικό δεδομένου ότι ο λιπώδης ιστός στην παχυσαρκία είναι γνωστό ότι εκκρίνει υψηλότερα επίπεδα αγγειοτενσίνης 2, ένα φλεγμονώδες συστατικό του συστήματος αλδοστερόνης ρενίνης-αγγειοτενσίνης (RAAS), το οποίο είναι το κλειδί που οδηγεί σε πολλές από τις παθολογικές επιπλοκές που σχετίζονται με αυτήν την κατάσταση [53].
Η παχυσαρκία φαίνεται επίσης να σχετίζεται με αυξημένη έκφραση του ACE2 στον πνεύμονα και με αυξημένους φλεγμονώδεις δείκτες και δυσρυθμισμένη λιπογένεση. Οι ιοί είναι γνωστό ότι εκβιάζουν τον μεταβολισμό των λιπιδίων ως μέρος του κύκλου ζωής τους [54].
Αν και το ACE2 δεν εκφράζεται ιδιαίτερα σε ανοσοκύτταρα, είναι πιθανό ότι άλλες πρωτεΐνες που εκφράζονται σε ανοσοκύτταρα θα μπορούσαν να δρουν ως υποδοχείς SARS-CoV-2, όπως το CD26 (επίσης γνωστοί ως διπεπτιδυλο πεπτιδάση 4, DPP4) ή CD147 (επίσης αποκαλούμενο basigin) ). Το CD147 μπορεί να ενεργοποιηθεί από κυκλοφιλίνες, οι οποίες αναστέλλονται από την κυκλοσπορίνη Α.
Η έκφραση αυτών των πιθανών υποδοχέων αλλάζει με την ηλικία, καθώς και με συννοσηρότητες, όπως η παχυσαρκία και η υπέρταση [33]. Έτσι, τόσο το CD147 όσο και η κυκλοφιλίνη Α έχουν προταθεί ως πιθανοί στόχοι για τη θεραπεία του ιού. Για παράδειγμα, η κυκλοσπορίνη είναι πολύ αποτελεσματική κατά των κορονοιών. Ωστόσο, οι ανοσοκατασταλτικές δράσεις της θα περιόριζαν τη χρησιμότητά της [55].
Η έκφραση CD147 και ACE2 αυξάνεται συχνά σε πνευμονική νόσο, με αποτέλεσμα την υπερβολική ενεργοποίηση του RAAS και την ενίσχυση της βλάβης, η οποία θα μπορούσε, εν μέρει, να εξηγήσει την προέλευση της καταιγίδας κυτοκινών.
Έχει προταθεί ότι η μελατονίνη, ένα ισχυρό φυσικό αντιοξειδωτικό, θα μπορούσε να καταστέλλει τη φλεγμονώδη οδό CD147 και να βοηθήσει στη θεραπεία ασθενών με COVID-19 [56]. Σε μελέτες δέσμευσης πυριτίου φαίνεται να υποστηρίζουν την πιθανότητα ότι ο ιός χρησιμοποιεί πράγματι το CD147 ως υποδοχέα και θα μπορούσε, ενδεχομένως, να εξηγήσει γιατί η λεμφοπενία σχετίζεται με τη σοβαρότητα του COVID-19 και την απώλεια υποσυνόλων των Τ-κυττάρων [57].
Τα δεδομένα δείχνουν ότι αυτός ο ιός μπορεί επίσης να συνδεθεί με τη νευροπιλίνη-1 (Nrp-1). Αυτή η πρωτεΐνη εκφράζεται σε πολλά κύτταρα, συμπεριλαμβανομένων αυτών στο κεντρικό νευρικό και ανοσοποιητικό σύστημα, και είναι επίσης ένας υποδοχέας του αγγειακού ενδοθηλιακού αυξητικού παράγοντα Α (VEGF-A) [34, 35, 58].
Εκτός από την υπόδειξη ότι μπορεί έτσι να μολύνει το κεντρικό νευρικό σύστημα (ΚΝΣ), φαίνεται επίσης ότι το SARS-CoV-2 μπορεί να προκαλέσει αναλγησία – η οποία θα μπορούσε να βοηθήσει στην αυξημένη μετάδοση νόσων σε ασυμπτωματικά άτομα [59].
Το Nrp-1 είναι επίσης το επίκεντρο των θεραπειών ανοσοθεραπείας στην ογκολογία, καθώς εκφράζεται σε υποσύνολα των ρυθμιστικών Τ-κυττάρων [60]. Υπάρχουν επίσης δεδομένα που δείχνουν ότι εκφράζονται στο καρδιαγγειακό σύστημα. Εάν η έκφρασή του μειωθεί, οδηγεί σε καρδιακή μιτοχονδριακή δυσλειτουργία καθώς ελέγχει τον κύριο μιτοχονδριακό ρυθμιστή, τον ενεργοποιημένο με πολλαπλασιαστή πολλαπλασιασμού υποδοχέας γάμμα συν-ενεργοποιητής 1-άλφα (PGC1α), καθώς και τον υποδοχέα ενεργοποίησης του πολλαπλασιασμού του υπεροξειδίου γ (PPARγ) [61].
Αυτά τα δεδομένα υποδηλώνουν ότι ο ιός όχι μόνο ρυθμίζει τα βασικά συστατικά του RAAS που επηρεάζουν τη φλεγμονώδη ισορροπία μέσω ACE2, αλλά τροποποιεί επίσης την απόκριση των Τ-κυττάρων απευθείας, για παράδειγμα, μέσω CD147, ή του TCR, ή ακόμη και Nrp-1 .
5. Οι ιοί SARS κωδικοποιούν πρωτεΐνες που στοχεύουν στα μιτοχόνδρια;
Στο SARS-CoV-1 το ανοιχτό πλαίσιο ανάγνωσης-9b (ORF-9b) κωδικοποιεί μια πρωτεΐνη που εντοπίζει το μιτοχόνδριο.
Εδώ προκαλεί σύντηξη προκαλώντας την αποδόμηση της Dynamin πρωτεΐνης 1 (DRP-1), ενώ αναστέλλει τις μιτοχονδριακές πρωτεΐνες αντιιικής σηματοδότησης (MAVS).
Αυτό πιστεύεται ότι στηρίζει την ικανότητά του να καταστέλλει την αντιιική αντίδραση της ιντερφερόνης. Μπορεί επίσης να προκαλέσει αυτοφαγία και να ενεργοποιήσει τον παράγοντα μεταγραφής και το μονοπάτι NF-κB [62].
Τα MAVS είναι μικρές πρωτεΐνες που ανιχνεύουν ολιγομερή δίκλωνο RNA (dsRNA) στα μιτοχόνδρια για να σχηματίσουν μια πλατφόρμα σηματοδότησης και να ξεκινήσουν την σηματοδότηση ιντερφερόνης, καθώς και κυτταρικό θάνατο [63α, 64]. Φαίνεται επίσης ότι το MAVS μπορούν να δρουν ως πρωτεΐνες προσαρμογής για το NLRP3, σχηματίζοντας ένα σύμπλεγμα με τα μιτοχόνδρια, αν και τα φλεγμονώματα μπορούν επίσης να ενεργοποιηθούν με τρόπο που δεν προκαλεί απόκριση ιντερφερόνης, αλλά μπορεί να προκαλέσει την απόκριση ιντερλευκίνης βήτα (IL-β) [65].
Όσον αφορά τον SARS-CoV-2, η χαρτογράφηση αλληλεπίδρασης πρωτεΐνης δείχνει ότι μοιράζεται μεγάλη ομολογία με το SARS-CoV-1, αλλά σημαντικά, αρκετές από τις πρωτεΐνες του προβλέπεται επίσης να αλληλεπιδρούν άμεσα με τα μιτοχόνδρια, όπως οι μη δομικές πρωτεΐνες ( NSPs) 4 και 8, και ORF9c, καθώς και συστατικά των οδών ιντερφερόνης και NF-κB [66].
Αυτό, λόγω του καλά προγραφέντος ρόλου των ιών στο χειρισμό των μιτοχονδριακών λειτουργιών, οδήγησε σε άλλες ομάδες που υποδηλώνουν ότι πράγματι, ο «εκβιασμός» των μιτοχονδρίων από το SARS-CoV-2 θα μπορούσε να αποτελέσει βασικό παράγοντα στην παθογένεση αυτού του ιού [67].
Πολλοί ιοί χρησιμοποιούν επίσης ιικές πρωτεΐνικές πορίνες που μπορούν να ολιγομεριστούν για να βοηθήσουν την είσοδο και την απελευθέρωση του ιού, καθώς και τον έλεγχο ενδοκυτταρικών ιόντων σηματοδότησης, όπως ασβέστιο ή κάλιο. Μπορούν επίσης, μέσω άμεσης αλληλεπίδρασης πρωτεΐνης, να χειριστούν τις οδούς σηματοδότησης.
Το κύτταρο ξενιστής τα εντοπίζει ως αλλαγές στα επίπεδα ιόντων και στο ROS και μέσω, για παράδειγμα, του φλεγμονώδους NLRP3, ενεργοποιεί την κυτταρική άμυνα [68].
Ο SARS-CoV-1 έχει τουλάχιστον τρεις ιοπορίνες, δύο από τις οποίες είναι απαραίτητες για αναπαραγωγή και τοξικότητα [69]. Η πρωτεΐνη Ε, ειδικότερα, όχι μόνο φαίνεται να προκαλεί δραστικότητα Ρ38 ΜΑΡΚ, αλλά επίσης φαίνεται να ρυθμίζει τη ροή ασβεστίου ενεργώντας ως διαπερατό κανάλι ιόντων στις ενδοπλασματικές μεμβράνες του ενδοπλασματικού δικτύου-Golgi (ERGIC) / Golgi, ενεργοποιώντας τα φλεγμονώματα [70].
Ο SARS-CoV-2 φαίνεται να έχει παρόμοια Ε ιοροπορίνη που προκαλεί ιοντική ανισορροπία [71]. Από τη σκοπιά του ασβεστίου και της σηματοδότησης ROS αυτό είναι ιδιαίτερα σημαντικό, καθώς τα μιτοχόνδρια δεν είναι μόνο καθοριστικά στο ρυθμιστικό διάλυμα ασβεστίου και στη σηματοδότηση, αλλά ελέγχονται επίσης από ασβέστιο [72].
Τα δεδομένα υποδηλώνουν ότι πολλοί ιοί σχηματίζουν ιογενή «εργοστάσια», τα οποία κατασκευάζονται από μεμβράνες κυττάρων-ξενιστών και συχνά συνδέονται στενά με τα μιτοχόνδρια για να παρέχουν πρόδρομους και ενέργεια – και αυτό περιλαμβάνει τα Coranoviridae [73,74].
6. Το SARS-Cov-2 μπορεί να ενισχύσει την αερόβια γλυκόλυση για να ευνοήσει την αντιγραφή του
Τα αναδυόμενα δεδομένα υποδηλώνουν τώρα ότι η ανοσία που προκαλείται από τα Τ-κύτταρα μπορεί να παίζει ισχυρό ρόλο στην προστασία από τον ιό, καθώς πολλοί ασυμπτωματικοί άνθρωποι ή εκείνοι που είχαν μόνο ήπια συμπτώματα, εμφανίζουν χαμηλά επίπεδα αντισωμάτων κατά του SARS-CoV-2 αλλά μια ισχυρή απόκριση διαμεσολαβούμενων από Τ-κύτταρα κατά του ιού.
Αντιθέτως, η πιο σοβαρή νόσος σχετίζεται με ταχύτερη ορομετατροπή και την παρουσία φλεγμονωδών δεικτών, όπως την C-αντιδρώσα πρωτεΐνη (CRP) [75,76]. Στην πραγματικότητα, τώρα φαίνεται ότι η σοβαρότητα της λοίμωξης συσχετίζεται θετικά με μια μειωμένη απόκριση ιντερφερόνης τύπου 1 (IFN1), αλλά μια υπερβολική φλεγμονώδη απόκριση, που χαρακτηρίζεται από υψηλά επίπεδα ιντερλευκίνης 6 (IL-6) και του παράγοντα νέκρωσης όγκου άλφα (TNFα) – πιθανώς σχετίζεται με την υπερβολική δραστηριότητα του πυρηνικού παράγοντα κάπα Β (NF-κB).
Αυτό το τελευταίο εύρημα θα μπορούσε να σχετίζεται με έναν αυτοφλεγμονώδη βρόχο στους πνεύμονες [77]. Φαίνεται ότι σε μερικούς ανθρώπους η μεταγραφική απόκριση στον SARS-CoV-2 είναι μη ισορροπημένη, με λιγότερο από τη βέλτιστη απόκριση ιντερφερόνης-I και -III, αλλά με υπερβολική χημειοκίνη. Αυτό μπορεί να αντιπροσωπεύει έναν εξελισσόμενο χειρισμό του ανοσοποιητικού συστήματος από τον ιό που επιδεινώνει τα αποτελέσματα για ηλικιωμένους ασθενείς με συννοσηρότητα, καθώς δεν μπορούν να αποβάλλουν σωστά τον ιό [78].
Δεδομένα από αυτοψίες νεκρών ασθενών με COVID-19 δείχνουν ότι η φλεγμονή των ιστών και η δυσλειτουργία των οργάνων δεν αντιστοιχούν στην κυτταρική κατανομή του ιού, υπονοώντας την ανοχή σε συγκεκριμένους ιστούς. Στην πραγματικότητα, οι σοβαρές φλεγμονώδεις αλλαγές φαίνεται να περιορίζονται σε μεγάλο βαθμό στους πνεύμονες και στο δίκτυο του ενδοθηλιακού συστήματος.
Αυτό πρότεινε ότι θάνατοι που σχετίζονται με COVID-19 οφείλονταν σε ανοσοδιαμεσολάβηση, παρά σε φλεγμονή και ζημίας οργάνων [79]. Μπορεί επομένως να είναι σημαντικό ότι η IFN1 μπορεί επίσης να έχει κάποιες αντιφλεγμονώδεις δράσεις, διαμορφώνοντας για παράδειγμα τα φλεγμονώματα NLRP1 / 3 και αναστέλλοντας την παραγωγή ιντερλευκίνης-1 (IL-1) [80]. Οι ιντερφερόνες τύπου 1 είναι το κλειδί στη διαμόρφωση των αποκρίσεων των κυττάρων Τ και της αντοχής στους ιούς [81 ,82].
Έχει προταθεί ότι καθώς ο ιός χρησιμοποιεί το ACE2 ως υποδοχέα στην κυτταρική επιφάνεια, θα μπορούσε να προκαλέσει ενεργοποίηση του συστήματος ρενίνης-αγγειοτενσίνης-αλδοστερόνης (RAAS), το οποίο με τη σειρά του, οδηγεί σε υπερενεργοποίηση των NLRP3 φλεγμονωμάτων και πυρόπτωσης, μια μορφή κυτταρικού θανάτου που οδηγεί στην ενίσχυση της φλεγμονής [81].
Τα δεδομένα φαίνεται τώρα να το υποστηρίζουν και έχουν παρουσιαστεί σε διάφορους τύπους ανθρώπινων βλαστικών κυττάρων – τα οποία θα μπορούσαν ενδεχομένως να επηρεάσουν την αναγέννηση των ιστών [83].
Το ACE2 διασπά την αγγειοτενσίνη II για να παράγει αγγειοτενσίνη (1-7), η οποία είναι σε μεγάλο βαθμό αντιφλεγμονώδης και προστατευτική [84]. Τα μιτοχόνδρια έχουν λειτουργικό σύστημα αγγειοτασίνης [85] και το ACE2 φαίνεται να είναι μιτοχονδριακά προστατευτικό [86].
Ενδεχομένως να ενδιαφέρει εδώ ότι ένα προϊόν του ACE2, η αγγειοτασίνη- (1-9), φαίνεται να αναστέλλει τη μιτοχονδριακή σχάση στην καρδιά, ενισχύοντας τη μιτοχονδριακή σύντηξη και το ρυθμιστικό διάλυμα ασβεστίου και προστατεύοντας από την καρδιακή υπερτροφία [87]. Είναι επομένως πιθανό, με τη δέσμευση στο ACE2, ο ιός να μπορεί να καταστέλλει μια αντιφλεγμονώδη οδό που επηρεάζει τη μιτοχονδριακή λειτουργία.
Γιατί λοιπόν να το κάνει αυτό το SARS-CoV-2; Μία πιθανή εξήγηση είναι ότι ο ιός επηρεάζει τα πιο διαδεδομένα ανοσοκύτταρα στους πνεύμονες, μονοκύτταρα / μακροφάγα, προκαλώντας τα να μετακινηθούν μεταβολικά σε αερόβια γλυκόλυση, η οποία ευνοεί την ανάπτυξη του ιού.
Η μόλυνση, η παρουσία οξυγόνου, φαίνεται να το επιτυγχάνει ενεργοποιώντας την παραγωγή μιτοχονδριακών αντιδραστικών ειδών οξυγόνου (ROS), σταθεροποιώντας τον επαγώγιμο από υποξία παράγοντα-1α (HIF-1α), ο οποίος στα μονοκύτταρα, αναστέλλει τις αποκρίσεις των Τ-κυττάρων και στους πνεύμονες προκαλείται επιθηλιακός κυτταρικός θάνατος. Φαίνεται ότι τα υψηλά επίπεδα γλυκόζης προκαλούν αντιγραφή του ιού [88].
Επιπλέον, τα φλεγμονώματα μπορούν επίσης να ρυθμίσουν τη γλυκόλυση. Στα μακροφάγα, αυτή μπορεί να είναι μια βασική διαδικασία στον μεταβολικό επαναπρογραμματισμό [89].
Η ενεργοποίηση των φλεγμονωμάτων μπορεί να ανασταλεί από τον πυρηνικό παράγοντα, Nfe2l2/Nrf2, το οποίο είναι καθοριστικό για την ενίσχυση της αντιοξειδωτικής άμυνας και την καταστολή της φλεγμονής [90]. Επομένως αντισταθμίζει το NF-κB, το οποίο είναι επίσης ενεργοποιημένο από την οξειδοαναγωγή, αλλά είναι κεντρικό στην ανοσοαπόκριση [91].
Ένας άλλος βασικός παράγοντας είναι ότι το γονιδίωμα του SARS-CoV-2 κωδικοποιεί πρωτεΐνες που μπορούν να στοχεύσουν την οδό NF-κB [66].
Το SARS-COV-2 φαίνεται συνεπώς να προκαλεί μετατόπιση Warburg (αερόβια γλυκόλυση), η οποία είναι μια τακτική που χρησιμοποιούν πολλοί άλλοι ιοί και καρκινικά κύτταρα [47]. Είναι λοιπόν σημαντικό το ότι ο μεταβολικός επαναπρογραμματισμός που προκαλείται από το SARS-CoV-2 μπορεί να κατασταλεί από τη μελατονίνη [92], το οποίο είναι ένα ισχυρό αντιοξειδωτικό που προστατεύει τα μιτοχόνδρια [93].
Στην πραγματικότητα ο SARS-CoV-2 φαίνεται επίσης να προκαλεί ενεργοποίηση οδών όπως η ενεργοποιημένη πρωτεΐνη κινάσης με μιτογόνο ρ38 (MAPK), η οποία έχει ως αποτέλεσμα τη διακοπή του κυτταρικού κύκλου, την αναστολή της απόπτωσης και οδηγεί σε έναν φλεγμονώδη βρόχο τροφοδοσίας προς τα εμπρός [94]. Τα συστήματα που στοχεύει επομένως φαίνεται να έχουν πολλά κοινά με αυτά που έχουν μεταβληθεί και στον καρκίνο [95].
Τα MAPK ρυθμίζουν επίσης τη μιτοχονδριακή λειτουργία, για παράδειγμα, αλληλεπιδρούν με το εξαρτώμενο από την τάση κανάλι ανιόντων 1 (VDAC1) [96]. Αυτό φαίνεται να προσθέτει στον ιό που χειρίζεται διάφορες οδούς για να ρυθμίσει την αερόβια γλυκόλυση, η οποία πρέπει να περιλαμβάνει την μιτοχονδριακή λειτουργία.
Ο διαβήτης σχετίζεται επίσης με την ενεργοποίηση του p38 MAPK μέσω ROS που δημιουργούνται από την μιτοχονδριακή δυσλειτουργία που προκαλείται από την γλυκόζη και μπορεί να αντισταθμιστεί από στοχευμένα μιτοχονδριακά αντιοξειδωτικά [97,98 ].
Όχι μόνο ο διαβήτης είναι παράγοντας κινδύνου για μια χειρότερη έκβαση στη μόλυνση με SARS-CoV-2, αλλά ο ίδιος ο ιός μπορεί να προκαλέσει επιδείνωση της κατάστασης [99,100 ,101].
Πράγματι, φαίνεται τώρα ότι η γλυκόζη στο αίμα νηστείας είναι ένας προγνωστικός δείκτης θνησιμότητας για ασθενείς με COVID-19 [102]. Συνολικά, ο διαβήτης ή / και ο διαβήτης τύπου 2 (T2D) αγκαλιάζεται από την έννοια του μεταβολικού συνδρόμου στο οποίο η αντίσταση στην ινσουλίνη, η μιτοχονδριακή δυσλειτουργία και η φλεγμονή είναι όλα συστατικά του [12].
Η μετφορμίνη, η οποία ρυθμίζει τη μιτοχονδριακή λειτουργία, αποτελεί βασική θεραπεία για το T2D [103] – και έχει δείξει κάποιο όφελος σε ασθενείς με COVID-19 [104,105].
Αντίθετα, τα στοιχεία δείχνουν ότι η φλεγμονώδης επίδραση της Δυτικής διατροφής μπορεί να προκαλέσει ενεργοποίηση του φλεγμονώδους NLRP3 [106]. Υπό το φως των αναδυόμενων δεδομένων, αυτό θα μπορούσε να επιδεινώσει μόνο την πιθανότητα υπερβολικής φλεγμονώδους απόκρισης.
7. Ο SARS-CoV-2 θα μπορούσε να οδηγήσει σε μιτοχονδριακό στρες
Είναι επομένως πιθανό ότι ο SARS-CoV-2 ρυθμίζει τη μιτοχονδριακή λειτουργία. Θα μπορούσε, λοιπόν, να υποτεθεί ότι αυτός ο ιός θα μπορούσε να διασφαλίσει τη στενή πρόσδεση του στα μιτοχόνδρια και μέσω της ροής ασβεστίου να διεγείρει τη λειτουργία τους.
Σαφώς, εάν αυτή η διαδικασία ήταν συντριπτική, ή τα μιτοχόνδρια είχαν ήδη τεθεί σε λειτουργικό κίνδυνο, αυτό θα οδηγούσε γρήγορα σε μιτοχονδριακό στρες. Σχετικά με αυτό, ο Singh και οι συνεργάτες του έχουν επισημάνει έναν ενδιαφέρον σύνδεσμο μεταξύ των ιών και την παραγωγή κυστιδίων που προέρχονται από μιτοχονδριακά (MDVs), τα οποία συνήθως αποτελούν μέρος ενός συστήματος για την αφαίρεση κατεστραμμένων συστατικών από το μιτοχόνδριο [6].
Εάν, όπως ο SARS-CoV-1, αυτός ο νέος ιός το κάνει επίσης και προκαλεί επίσης μιτοχονδριακή σύντηξη, υπονοεί μια ενδιαφέρουσα ικανότητα πρόληψης της απόπτωσης, καθώς και της μιτοφαγίας, αλλά διεγείρει έναν μηχανισμό μετακίνησης σωματιδίων του ιού.
Εάν αναστέλλει επίσης τη δράση MAV, τότε το μιτοχόνδριο ενδέχεται να μην ξεκινήσει τη σηματοδότηση ιντερφερόνης, αλλά θα μπορούσε να συνεχίσει, ενδεχομένως παράγοντας υψηλότερα από τα κανονικά επίπεδα ROS, για να διεγείρει την φλεγμονώδη δραστηριότητα και τον μεταβολικό αναπρογραμματισμό προς τη γλυκόλυση.
Στην πραγματικότητα, ο ιός αναπρογραμματίζει τον κανονικό φλεγμονώδη μεταβολικό αναπρογραμματισμό προς την αερόβια γλυκόλυση, η οποία περιλαμβάνει διαμόρφωση της μιτοχονδριακής λειτουργίας, αλλά καταφέρνει να καταστείλει τη φυσιολογική αντίδραση ιντερφερόνης. Σε πολλούς ιστούς, το σύστημα μπορεί να καταφέρει να παραμείνει σε ισορροπία και να μην προκαλέσει υπερβολική ενεργοποίηση του ανοσοποιητικού συστήματος, αλλά στους πνεύμονες, φαίνεται ότι σε μερικούς ανθρώπους, αυτή η ισορροπία έχει χαθεί. Η εικόνα 1 συνοψίζει ακριβώς αυτό.
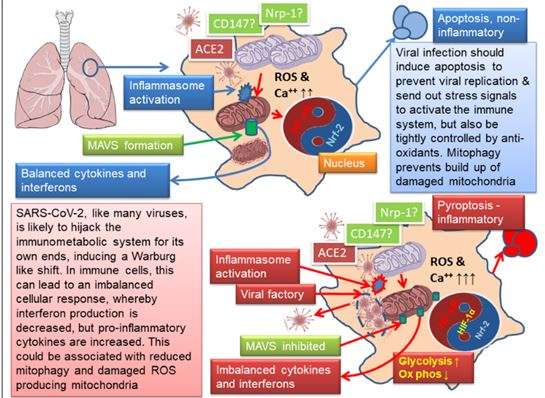

Εικόνα 1 Οι ιοί όπως το SAR-CoV-2 χειρίζονται τον κυτταρικό μεταβολισμό που οδηγεί στο ενδεχόμενο ενός φλεγμονώδους βρόχου προς τα εμπρός. Οι ιοί έχουν εξελιχθεί για να σφετερίσουν τον κυτταρικό μηχανισμό του ξενιστή τους για να κάνουν περισσότερους ιούς. Ένας κοινός μηχανισμός είναι η καταστολή της απόπτωσης και ο χειρισμός του ανοσοποιητικού συστήματος για την αναστολή συγκεκριμένων προγραμμάτων κατά των ιών, που σημαίνει συνήθως ιντερφερόνες, ενώ ταυτόχρονα διεγείρεται μια μετατόπιση προς την αεροβική γλυκόλυση για να παρέχει πρόδρομους για τη δημιουργία νέων ιών. Ωστόσο, αυτή η τελευταία ικανότητα επανατοποθετεί μονοπάτια που συχνά εμπλέκονται σε γενικευμένη ανοσία που και οι δύο αυξάνουν την παραγωγή προφλεγμονωδών διαμεσολαβητών, ενώ μεταβολίζουν τον προγραμματισμό ανοσοκυττάρων. Στην περίπτωση του SARS-CoV-2, αυτό μπορεί να οδηγήσει σε έναν προ-φλεγμονώδη βρόχο τροφοδοσίας προς τα εμπρός στους πνεύμονες, ο οποίος φαίνεται να οδηγείται από μονοκύτταρα / μακροφάγο σε αερόβια γλυκόλυση και οδηγεί το μιτοχονδριακό ROS μου και τη σταθεροποίηση του HIF-1α. Με τη σειρά του, αυτή η μεταβολική μετατόπιση καταστέλλει τα κύτταρα Τ και την απόκριση ιντερφερόνης [88]. Αυτή η διαδικασία τονίζεται καθώς ο ιός μπορεί να διεγείρει την ενεργοποίηση του φλεγμονώματος [81], ενώ εάν είναι παρόμοιος SARS-CoV-1, θα μπορούσε επίσης να καταστέλλει το σχηματισμό MAVS και να ενεργοποιήσει το NF-kB [62]. Η χαρτογράφηση αλληλεπίδρασης πρωτεΐνης υποδηλώνει ότι συμβαίνει αυτό [66]. Καθώς είναι πιθανό ότι η φλεγμονώδης ενεργοποίηση μπορεί επίσης να προκαλέσει γλυκόλυση [89], τότε η εξελικτική λογική φαίνεται καλή. Ιδιαίτερη σημασία εδώ είναι επίσης η ισορροπία μεταξύ NF-kB και Nrf2, η οποία λίγο πολύ φαίνεται να αντισταθμίζει το ένα το άλλο, καθώς το Nrf2 είναι καθοριστικό στην καταστολή του υπερβολικού οξυγόνου στρες [91]. Για πιο λεπτομερείς ανασκοπήσεις του ρόλου των μιτοχονδρίων στην ανοσοαπόκριση βλ. [22, 107]
8. Το ανοσοποιητικό σύστημα, ορμή ( hormesis) και μιτοχόνδρια
Όπως υποδεικνύεται, εάν ο ιός ρυθμίζει τη μιτοχονδριακή λειτουργία σε ποικίλους τύπους κυττάρων, είτε άμεσα είτε έμμεσα, τότε όσο πιο ισχυρό είναι το μιτοχονδριακό σύστημα, τόσο μεγαλύτερη είναι η πιθανότητα του συστήματος να είναι σε θέση να αντισταθεί στον ιό.
Γενικά, παράγοντες όπως η άσκηση, φαίνεται να είναι απαραίτητοι για τη διατήρηση της μιτοχονδριακής υγείας σε όλο το σώμα. Αυτός ο φαινότυπος σχετίζεται με μια πιο ισορροπημένη ανοσοαπόκριση και ελαχιστοποίηση της «φλεγμονής». Σε αυτήν την ενότητα εξετάζουμε γιατί συμβαίνει αυτό και εξετάζουμε γιατί ένας από τους φυσικούς ξενιστές του ιού, η νυχτερίδα, μπορεί να αντισταθεί.
9. Ένα ισχυρό μιτοχονδριακό σύστημα και ένα αποτελεσματικό ανοσοποιητικό σύστημα μπορεί να βασίζονται στην hormesis.
Ένα βασικό συστατικό της αποτελεσματικής ανοσίας θεωρείται τώρα ότι είναι ένα υγιές μιτοχονδριακό σύστημα [107], ενώ ένα υποκείμενο ενοποιητικό στοιχείο τόσο της διαδικασίας γήρανσης όσο και των συνθηκών που σχετίζονται με έναν κακό τρόπο ζωής είναι η υποβάθμιση της συνολικής μιτοχονδριακής λειτουργίας / αποθεματικού και η αύξηση του οξειδωτικού στρες και φλεγμονής [4,5].
Ένας σημαντικός παράγοντας στη διατήρηση της μιτοχονδριακής λειτουργίας είναι η hormesis όπου τα χαμηλά επίπεδα στρες προκαλούν μια υπεραντισταθμιστική απόκριση που προκαλεί θετικές προσαρμογές, επιτρέποντας σε έναν οργανισμό να ανέχεται καλύτερα το στρεσογόνο ερέθισμα την επόμενη φορά που θα τον αντιμετωπίσει.
Για παράδειγμα, μια αποτελεσματική ορμονική απόκριση μπορεί να προκληθεί από την σωματική δραστηριότητα, τον περιορισμό των θερμίδων και την κατανάλωση πολλών φυτικών πολυφαινολών [12], με το μιτοχονδριακό άγχος να αποτελεί βασική ώθηση [108].
Αυτό οδηγεί σε αυξημένη αναπνευστική ικανότητα και αντιοξειδωτική ικανότητα και μεγαλύτερη ικανότητα διαχείρισης του λόγου ATP / ROS όταν το μιτοχονδριακλο σύστημα τίθεται υπό πίεση [109].
Είναι γνωστό ότι, μικρά και μακράς διαρκείας ζωής είδη όπως οι νυχτερίδες και σπουργίτια, σε σύγκριση με μικρά είδη συντομότερης διάρκειας ζωής όπως τα ποντίκια, εμφανίζουν στα μιτοχόνδρια χαμηλότερα επίπεδα απελευθέρωσης υπεροξειδίου του υδρογόνου [110].
Δεδομένου ότι η μιτοχονδριακή δυσλειτουργία συσχετίζεται έντονα με την ανοσολογική δυσλειτουργία και τη χρόνια φλεγμονή [111], τότε η επίλυση της φλεγμονής πιθανότατα θα επιτευχθεί καλύτερα διασφαλίζοντας υγιή μιτοχονδριακή λειτουργία καθώς διασφαλίζει ότι η απελευθέρωση ROS δεν ξεφεύγει από τον έλεγχο.
10. Τι μπορούν να μας πουν οι νυχτερίδες;
Η έννοια της hormesis υποδηλώνει ότι είναι σημαντικό να τονώνουμε συνεχώς την ανανέωση και τη διατήρηση ενός μεγάλου πληθυσμού υγιών μιτοχονδρίων.
Είναι επομένως δυνατόν να μάθουμε κάτι από έναν από τους φυσικούς ξενιστές του SARS-CoV-2,δηλαδή τις νυχτερίδες [112]. Η νυχτερίδα είναι το μόνο ιπτάμενο θηλαστικό που υπάρχει και έχει εξαιρετικά μεγάλο χρόνο ζωής για το μέγεθός τους.
Αυτό θα μπορούσε να οφείλεται στο γεγονός ότι η εξέλιξη της πτήσης έχει απαιτήσει ένα πλήθος προσαρμογών, συμπεριλαμβανομένης της διατήρησης μιας μεγάλης δεξαμενής μιτοχονδρίων που παράγουν πολύ λίγο φορτίο ROS, διατηρώντας παράλληλα υψηλή απόδοση ATP.
Αυτό φαίνεται να συμβαδίζει με αλλαγές στο ανοσοποιητικό σύστημα για να αποτρέψει την υπερβολική φλεγμονώδη ενεργοποίηση από στρεσογόνα μιτοχόνδρια, για παράδειγμα, μειώνοντας τη δραστηριότητα των φλεγμονωμάτων NLRP3. Το καθαρό αποτέλεσμα είναι ότι πολλές νυχτερίδες μπορούν να ανεχθούν υψηλά επίπεδα ιών, όπως η οικογένεια Coronaviridae [113, 114, 115, 116] και δείχνουν μειωμένα αντισώματα και φλεγμονώδεις αποκρίσεις, υπονοώντας ότι χρησιμοποιούν άλλο μέρος του ανοσοποιητικού τους συστήματος για τον έλεγχο του ιού [117].
Τα φλεγμονώματα μπορούν επομένως να είναι σημαντικά, καθώς η ενεργοποίησή τους μπορεί να οδηγήσει σε πυρόπτωση, μια φλεγμονώδη μορφή απόπτωσης και μπορεί να προκληθεί από υπερβολικό μιτοχονδριακό στρες [118]. Μπορεί κάλλιστα να είναι ένα βασικό συστατικό της «inflammaging» [42].
Υπάρχουν κάποιες ενδείξεις ότι τουλάχιστον σε ορισμένα είδη νυχτερίδας, η υγεία των μιτοχονδρίων, παρά τις εκρήξεις οξειδωτικού στρες, διατηρείται από αυστηρούς μηχανισμούς ελέγχου της ποιότητας των μιτοχονδρίων, όπως η μιτοφαγία [119].
Η μιτοφαγία είναι στην πραγματικότητα ένας αρνητικός ρυθμιστής της φλεγμονώδους δραστηριότητας του NLRP3, οπότε αν και η μιτοχονδριακή βλάβη μπορεί να ενεργοποιήσει το φλεγμόνωμα, μπορεί επίσης να ενεργοποιήσει την αντισταθμιστική μιτοφαγία για να αποτρέψει την υπερβολική φλεγμονή [120].
Εν ολίγοις, φαίνεται ότι η δυναμική πτήση απαιτεί τη συνεξέλιξη και των μιτοχονδρίων που ελέγχουν αυστηρά το φορτίο ROS, και ενός συνπροσαρμοσμένου ανοσοποιητικού συστήματος.
Υπάρχουν ενδείξεις ότι ο SARS-CoV-2 αναστέλλει την αυτοφαγία [121], υποδηλώνοντας ότι μπορεί επίσης να αναστέλλει τη μιτοφαγία. Εάν αυτός ο ιός προκαλεί πράγματι μιτοχονδριακή σύντηξη, όπως μπορεί να κάνει ο SARS-CoV-1 [62], τότε αυτό θα σημαίνει ότι, καθώς η μιτοχονδριακή σύντηξη μπορεί να αναστέλλει τη μιτοφαγία και τον κυτταρικό θάνατο έτσι να διασφαλίζει την παραγωγή ενέργειας, αν και η παρατεταμένη σύντηξη μπορεί επίσης να ξεκινήσει το κυτταρικό θάνατο σε ορισμένες περιπτώσεις [122].
Αυτό το τελευταίο σημείο προτείνει έναν άλλο έμφυτο αντι-ιικό μηχανισμό. Συνολικά, η διαμόρφωση του φλεγμονώματος θα μπορούσε να είναι ένα στοιχείο στο πώς ο ιός θα μπορούσε να οδηγήσει σε έναν «φλεγμονώδη» φαινότυπο.
11. Άνθρωποι, hormesis, άσκηση και το ανοσοποιητικό σύστημα
Οι επιδράσεις της hormesis, σίγουρα για τον άνθρωπο, φαίνονται ίσως πιο ξεκάθαρα ως απόκριση στην προπόνηση και στην άσκηση, ιδίως στην αερόβια προπόνηση, όπου τόσο η μιτοχονδριακή ικανότητα όσο και η λειτουργία αυξάνεται σε νέους και στους ηλικιωμένους [123, 124].
Αυτό συνδυάζεται με την αυξημένη επιβίωση και την υγιέστερη γήρανση σε ομάδες που ακολουθούν σωματική δραστηριότητα [125]. Ο ενεργός μυς είναι γενικά φλεγμονώδης, αλλά ταυτόχρονα προκαλεί αντισταθμιστικούς ισχυρούς αντιφλεγμονώδεις και αντιοξειδωτικούς μηχανισμούς σε όλο το σώμα.
Η άσκηση φαίνεται λοιπόν να δείχνει μια διφασική απόκριση και τα στοιχεία δείχνουν ότι όσο δεν γίνεται υπερβολικά, ιδιαίτερα, επιτρέποντας χρόνο για ανάκαμψη, είναι εξαιρετικά ευεργετικό: με την πάροδο του χρόνου η προσαρμοστική υπερ-αντιστάθμιση περιλαμβάνει βελτιωμένη αντιφλεγμονώδη και αντιοξειδωτική ανατροφοδότηση [25-28, 126].
Έχει αποδειχθεί ότι ο μυς έχει άλλες λειτουργίες, όπως η αποθήκευση και παροχή αντι-ιικών βλαστικών κυττάρων Τ, ως εκ τούτου, ανταγωνιστική εξάντληση Τ-κυττάρων και προστασία του πολλαπλασιαστικού δυναμικού κατά τη διάρκεια της φλεγμονής [127].
Αντίθετα, ο λευκός λιπώδης ιστός παίζει βασικό ρόλο στην προσαρμοστική ανοσία και, επιπλέον, συμβάλλει στην αλλοιωμένη ανοσολογική λειτουργία και τη χρόνια φλεγμονή που συχνά σχετίζεται με την παχυσαρκία [128].
Συγκεκριμένα, ο υπερβολικός σπλαχνικός λιπώδης ιστός, φαίνεται να παίζει καθοριστικό ρόλο στην παθογένεση που σχετίζεται με την παχυσαρκία και ο όγκος του μειώνεται κατά την άσκηση [129].
Επιπλέον, όχι μόνο η ιντερφερόνη τύπου 1 ξεκλειδώνει το αδρανές φλεγμονώδες δυναμικό των λιποκυττάρων [130], αλλά η άσκηση μειώνει την έκφραση του λιπώδους NLRP3 [131].
Φαίνεται λοιπόν ότι ο λιπώδης ιστός και οι μύες διαδραματίζουν ένα ρόλο γιν-γιανγκ στην ανοσοαπόκριση, του οποίου το καθοριστικό σημείο θα προσδιοριστεί από την ατομική φυσική κατάσταση και των προσλαμβανόμενων θερμίδων και τη συνολική ικανότητα και υγεία των μιτοχονδρίων καθώς και το μιτοχονδριακό απόθεμα.
Εν ολίγοις, το μιτοχονδριακό απόθεμα, και επομένως η πλεονάζουσα αναπνευστική ικανότητα, είναι καθοριστικής σημασίας για την ενίσχυση του «healthspan» και βελτιώνεται σημαντικά με την άσκηση [109].
Το κλειδί εδώ είναι ότι το άγχος μπορεί να σηματοδοτηθεί από τα μιτοχόνδρια σε οποιονδήποτε ιστό στο υπόλοιπο σώμα μέσω «μιτοκινών» και η μυϊκή δραστηριότητα αποτελεί τον πρωταρχικό παράγοντα του μιτοχονδριακού στρες [132].
12. Μιτοχονδριακό απόθεμα και redox
Φαίνεται ότι ο έλεγχος της φλεγμονής συνδέεται με τον αυστηρό έλεγχο των μιτοχονδριακών φορτίων ROS, το οποίο εξαρτάται από την «mitohormesis» από παράγοντες όπως η άσκηση, οι φυτικές ενώσεις στη διατροφή και ο περιορισμός των θερμίδων [108,133].
Αυτό βασίζεται στο γεγονός ότι η ζωή βασίζεται στην διαδικασία redox και την τμηματική παραγωγή ROS ως μέρος ενός συστήματος σηματοδότησης [134,135]. Αυτό οδήγησε σε οξειδοαναγωγικές θεωρίες της νόσου και της γήρανσης, εστιάζοντας στο μιτοχόνδριο [136] και τον ρόλο τους στη δημιουργία μιας σχετιζόμενης με την ηλικία αύξησης του φλεγμονώδους τόνου [5], η οποία υποστηρίζει τον κεντρικό ρόλο των μιτοχονδρίων στο ανοσοποιητικό σύστημα [137] και την αντίσταση σε λοιμώξεις, συμπεριλαμβανομένων ιών [138].
Προς υποστήριξη αυτού, υπάρχουν αυξανόμενες ενδείξεις ότι τα μιτοχόνδρια μπορούν επίσης να λειτουργήσουν ως εκκαθαριστές των ROS και αυτό συνδέεται με τη διάρκεια ζωής.
Για παράδειγμα, τα μιτοχόνδρια από τον μακρόβιο γυμνό αρουραίο (NMR) παράγουν λιγότερα ROS από τα συγκρίσιμα ζώα με μικρότερη διάρκεια ζωής [139,140]. Επιπλέον, τα μιτοχόνδρια στο γυμνό αρουραίο (NMR), και τις νυχτερίδες, φαίνεται να είναι σε θέση να διατηρήσουν την αποπόλωση της εσωτερικής μεμβράνης για πολύ περισσότερο κατά τη διάρκεια του κύκλου ζωής τους, ο οποίος είναι ένας βασικός μηχανισμός για τη μείωση της παραγωγής ROS κατά τη γήρανση [141].
Μια βασική ιδέα που σχετίζεται με αυτό είναι η υπόθεση Redox-Optimized ROS Balance (R-ORB), η οποία ορίζει ότι η μιτοχονδριακή εκπομπή ROS θα φτάσει σε ένα ναδίρ όταν ο αναπνευστικός ρυθμός φτάσει στο μέγιστο. Στην πραγματικότητα, τα μιτοχόνδρια θα μεγιστοποιήσουν την παραγωγή ATP και θα ελαχιστοποιήσουν τις ROS καθώς εξελίχθηκαν για να εργαστούν σε μια ενδιάμεση κατάσταση redox [142,143]. Έτσι, έχοντας ένα καλό μιτοχονδριακό απόθεμα, αυτό μπορεί να υποδηλώνει ότι αυτό το ναδίρ μπορεί να διατηρηθεί όταν το σύστημα τεθεί υπό πίεση.
Ένα βασικό συστατικό του μιτοχονδριακού ελέγχου είναι η αποσύνδεση. Πρόκειται για μια διαδικασία κατά την οποία η κλίση πρωτονίων στο μιτοχόνδριο αποσυνδέεται από την παραγωγή ATP και αρχικά φάνηκε να είναι μια βασική διαδικασία για τη μείωση της παραγωγής ROS, καθώς και για την παραγωγή θερμότητας.
Θεωρήθηκε επομένως ότι λειτουργεί ως μια πολύ καλή βαλβίδα ασφαλείας για τα μιτοχόνδρια και διαδραματίζει θεμελιώδη ρόλο στην επιβίωση και την πρόληψη των οξειδωτικών βλαβών.
Στην πραγματικότητα, το 20% ή περισσότερο της ενέργειας που συλλαμβάνεται από τη μεταφορά ηλεκτρονίων καταστρέφεται. Ωστόσο, η αποσύνδεση μπορεί επίσης να συσχετιστεί με την αύξηση του ROS, επομένως, αποτελεί βασικό συστατικό της σηματοδότησης redox – και οδήγησε σε ενημερωμένες επαναδιατυπώσεις της υπόθεσης «αποσύνδεση για επιβίωση».
Μπορεί επομένως να διαδραματίσει βασικό ρόλο στη mitohormesis, με αποτέλεσμα όχι μόνο τις αυτόνομες προσαρμογές των κυττάρων, αλλά και τη συστηματική προσαρμογή στα σήματα, για παράδειγμα, αποστέλλονται από στρες του σκελετικού μυός μέσω μιτοκινών.
Η αποσύνδεση ελέγχει επίσης τη σηματοδότηση ασβεστίου. Φαίνεται τώρα ότι η ήπια αποσύνδεση μπορεί, πράγματι, να οδηγήσει σε αυξημένη μακροζωία [144]. Είναι επομένως ίσως σχετικό ότι μια μιτοχονδριακή πρωτεΐνη αποσύνδεσης, το UCP2, μπορεί να ελέγξει αρνητικά το φλεγμονώδες ερέθισμα [145], και γενικά, φαίνεται να καταστέλλει την ανοσολογική δραστηριότητα [146].
Η αποσύνδεση παίζει επομένως σημαντικό ρόλο στην μιτοχονδριακή απόδοση, η οποία μπορεί είτε να οριστεί ως η αναλογία αναπνευστικού ελέγχου (RCR – λόγος μιτοχονδριακής αναπνοής που υποστηρίζει τη σύνθεση ATP προς εκείνη που απαιτείται για την αντιστάθμιση της διαρροής πρωτονίων) ή της αναλογίας ATP / οξυγόνου (η ποσότητα του ATP παράγεται ανά μονάδα κατανάλωσης οξυγόνου).
Αυτό μπορεί να οδηγήσει σε κάποια σύγχυση, καθώς μπορεί να οδηγήσει σε αντίθετα συμπεράσματα σχετικά με την αποτελεσματικότητα. Ωστόσο, όποια μέτρηση χρησιμοποιείται, περιγράφει την ικανότητα μετατροπής πόρων σε ATP και, στην πραγματικότητα, την απόδοση ζεύξης [147].
Μελέτη έχει δείξει ότι, τα μιτοχόνδρια των σκελετικών μυών σε παχύσαρκες, καθιστικές και ανθεκτικές στην ινσουλίνη γυναίκες παρουσιάζουν κάπως παράδοξα μειωμένη μιτοχονδριακή σύζευξη, αλλά υψηλότερη παραγωγή μιτοχονδριακού υπεροξειδίου υδρογόνου.
Έτσι, παρά τον βαθμό αποσύνδεσης, τα μιτοχόνδρια τους έδειχναν σημάδια οξειδωτικού στρες. Αυτό μπορεί να οφείλεται σε υπερφόρτωση από τα θρεπτικά συστατικά. Ένα πρόγραμμα προπόνησης άσκησης το διόρθωσε και συσχετίστηκε με τη βελτίωση της μιτοχονδριακής λειτουργίας, συγκεκριμένα δε, με την αυξημένη ικανότητα να λαμβάνει χώρα η βήτα οξείδωση των λιπών και την αποκατάσταση της μεταβολικής ευελιξίας, την ικανότητα εναλλαγής μεταξύ υδατανθράκων και λίπους ως πηγών ενέργειας και καλύτερη ευαισθησία στην ινσουλίνη [148].
Η φαινομενική αύξηση της αποσύνδεσης θα μπορούσε να είναι μέρος μιας ομοιοστατικής απόκρισης για τη μείωση της υπερβολικής παραγωγής ROS, καθώς τα UCPs μπορούν να ενεργοποιηθούν από το οξειδωτικό στρες [149]. Περαιτέρω στοιχεία δείχνουν ότι, η άσκηση προκαλεί μια προσαρμοστική απόκριση που επέτρεψε στο μιτοχονδριακό σύστημα να αντιμετωπίζει καλύτερα το οξειδωτικό φορτίο και τις ROS.
Τέλος, αξίζει ίσως να τονιστεί η σχέση μεταξύ των μιτοχονδριακών αποθεμάτων και της ικανότητας ελέγχου του οξειδωτικού στρες. Τα μιτοχόνδρια μπορούν να δημιουργήσουν ROS και συνδέονται στενά με τοn Nrf2 μηχανισμό, ο οποίος είναι ένας κύριος παράγοντας μεταγραφής που ελέγχει τις αντιοξειδωτικές αποκρίσεις [150].
Αυτό υποδηλώνει ότι η άσκηση όχι μόνο θα προκαλέσει μεγαλύτερα αποθέματα μιτοχονδρίων, αλλά και μεγαλύτερη αντιοξειδωτική ικανότητα – και ίσως, μεγαλύτερη ικανότητα εφεδρείας για αποσύνδεση για τη διαχείριση του οξειδωτικού στρες.
13. Γήρανση, αποθεματικό ανοσοποιητικού συστήματος και ανοσοαπόκριση
Όπως αναφέρθηκε προηγουμένως, όπως και ο αρχικός ιός SARS, αυτός ο νέος ιός φαίνεται επίσης να προκαλεί χειρότερα αποτελέσματα σε ασθενείς που είναι ηλικιωμένοι, έχουν υπέρταση και καρδιαγγειακές παθήσεις και προκαλεί φαινότυπο που χαρακτηρίζεται από αυξημένους δείκτες φλεγμονής και πήξης, ανεπάρκεια πολλαπλών οργάνων, καθώς και νευρολογικές επιπλοκές και τραυματισμό του μυοκαρδίου [151].
Εν ολίγοις, τα περισσότερα από τα παραπάνω ταυτίζονται με τη διαδικασία γήρανσης και το μεταβολικό σύνδρομο, και παράλληλα όλα αυτά σχετίζονται με τη μείωση της μιτοχονδριακής λειτουργίας [152,153].
Είναι συνεπώς σημαντικό ότι ο ρυθμός γήρανσης μπορεί να τροποποιηθεί από τον τρόπο ζωής και τις ασθένειες και ότι η επιγενετική καθιστά δυνατό τον προσδιορισμό, με κάποιο βαθμό ακρίβειας, της βιολογικής ηλικίας και τη σύγκριση της με τη χρονολογική ηλικία μέσω μεθυλίωσης τοτ DNA (DNAmAge) [154,155].
Παρόλο που τα μιτοχόνδρια προφανώς παίζουν ρόλο σε αυτό, και ο μειωμένος αριθμός αντιγράφων του μιτοχονδριακού DNA (mtDNAcn) φαίνεται να είναι ένας πρωταρχικός παράγοντας για τη ρυθμιστική ικανότητα των μιτοχονδρίων και συσχετίζεται αρνητικά με το DNAmAge, η ακριβής σχέση του με τη βιολογική ηλικία εξακολουθεί να είναι ασαφής.
Για παράδειγμα, τα στοιχεία δείχνουν σαφή ρόλο για τα μιτοχόνδρια σε ασθένειες και θνησιμότητα που σχετίζονται με τη γήρανση, αλλά όχι απαραίτητα με τη χρονολογική ηλικία [156].
Ωστόσο, τα δεδομένα υποδηλώνουν ότι η πρόκληση μιτοχονδριακής δυσλειτουργίας μόνο στα Τ-κύτταρα μπορεί να προκαλέσει πρόωρη γήρανση, να οδηγήσει σε «φλεγμονή» και μια τάση προς μια καταιγίδα κυτοκίνης [37].
Μία πολύ γνωστή ιδέα για τη γήρανση είναι η ιδέα της μείωσης του αποθεματικού οργάνων, η οποία σε μοριακό επίπεδο, σχετίζεται με απώλεια περίσσειας μεταβολικής ικανότητας – ιδίως βιοενέργειας και mtDNA, καθώς και της χωρητικότητας των τελομερών [157]. Από αυτή την άποψη, θα μπορούσε να υποστηριχθεί ότι το ανοσοποιητικό σύστημα θα μπορούσε να θεωρηθεί ως όργανο, και υπόκειται επίσης σε φθίνουσα διάσταση.
Καθώς το ανοσοποιητικό σύστημα μεγαλώνει υπάρχει υποκλινική συσσώρευση προ-φλεγμονωδών παραγόντων, καθώς και μειωμένος αριθμός κυκλοφορούντων αναπνευστικών μιτοχονδρίων που βρίσκονται σε εξωκυτταρικά κυστίδια (EVs), τα οποία προέρχονται από ανοσοκύτταρα [36].
Σε συνδυασμό με αυτό, υπάρχουν επίσης ενδείξεις ότι με την αύξηση της ηλικίας μεταβάλλεται η φλεγμονώδης απόκριση που προκαλείται από φλεγμονώδη μονοκύτταρα.
Για παράδειγμα, αυτή η απόκριση στη γρίπη Α διατηρείται, αλλά η αντίδραση κατά των ιών ιντερφερόνης μειώνεται [158]. Επιπλέον, η γήρανση σχετίζεται επίσης με τη σταδιακή απώλεια της αντιοξειδωτικής ικανότητας που σχετίζεται με μείωση της αντι-ιικής απόκρισης των T1 (Th1) κυττάρων, η οποία θα μπορούσε να βασιστεί σε μέρος της αντι-ιικής δραστηριότητας της γλουταθειόνης και άλλων αντι-οξειδωτικών [159,160]. Αυτό είναι σίγουρα ανάλογο με το μειωμένο αποθεματικό του ανοσοποιητικού συστήματος.
Ωστόσο, εξακολουθούν να υπάρχουν πολλά που δεν είναι κατανοητά για τη γήρανση, για αυτό οδήγησε ορισμένους συγγραφείς να την κατηγοριοποιήσουν χρησιμοποιώντας διάφορα ξεχωριστά χαρακτηριστικά, με τη μιτοχονδριακή λειτουργία να είναι μόνο ένα από τα πολλά ολοκληρωμένα συστήματα, καθώς η ακριβής αιτία δεν είναι ακόμη πλήρως κατανοητή [161].
Ωστόσο, πολλοί συγγραφείς συνεχίζουν να επικεντρώνονται στο μιτοχόνδριο – κυρίως επειδή αντιπροσωπεύει μια αρχαία σχέση που προέκυψε από το ενδοσυμβιωτικό συμβάν μεταξύ ενός προκαρυώτη και Archaean (Αρχαίου) που δημιούργησε τους ευκαρυώτες, και η κατανόηση αυτού παρέχει μια εικόνα για το ανοσοποιητικό σύστημα και τη φλεγμονή, και τη διαδικασία γήρανσης [152,162].
Ορισμένοι έχουν υποστηρίξει ότι η γήρανση σχετίζεται στην πραγματικότητα με την απώλεια της ικανότητας των μιτοχονδριακών αναπνευστικών πόρων. Αυτό έχει μεγάλη αξία, και σε σχέση με την αντίσταση στους ιούς, θα μπορούσε να θεωρηθεί από τη μείωση της βιοενέργειας / οξειδοαναγωγικής ικανότητας του ανοσοποιητικού συστήματος καθώς οι άνθρωποι γερνούν.
Ενδεικτικά, το μειωμένο mtDNAcn των σκελετικών μυών σχετίζεται με συμπτώματα του μεταβολικού συνδρόμου, ενώ η άσκηση αυξάνει το mtDNAcn και σχετίζεται αρνητικά με δείκτες του μεταβολικού συνδρόμου και αυξημένη αερόβια ικανότητα [163].
Έτσι, αν και σίγουρα δεν είναι ολόκληρη η ιστορία, η γήρανση σχετίζεται με τη μείωση της μιτοχονδριακής λειτουργίας, η οποία πιθανότατα σχετίζεται με μειωμένο ανοσοποιητικό «αποθεματικό» και ευελιξία. Ως εκ τούτου, ως βασικό παράγοντα για πιθανή σοβαρότητα όταν μολυνθεί κάποιος, η μιτοχονδριακή λειτουργία έχει τη θέση της στη διαδικασία γήρανσης.
Τα μαθήματα για τον άνθρωπο είναι επομένως αρκετά σαφή: η άσκηση είναι μέρος της εξελικτικής μας κληρονομιάς και παίζει βασικό ρόλο στη διατήρηση της βέλτιστης μιτοχονδριακής υγείας και της ανοσοποιητικής ισορροπίας (Εικ. 2 ).


Σχήμα 2 Αντοχή στο SARS-CoV-2: αποθεματικό μιτοχονδρίων και οξειδοαναγωγής, ορμή και μεταβολική / φλεγμονώδης εικόνα. Τα δεδομένα υποστηρίζουν σθεναρά ότι τα άτομα που έχουν αερόβια άθληση και ακολουθούν έναν υγιεινό τρόπο ζωής, τείνουν να έχουν μεγαλύτερο μεταβολικό και αντιοξειδωτικό απόθεμα σχετιζόμενο στην εκπαίδευση που προκαλείται από μιτοχονδριακές προσαρμογές. Αυτό συνδέεται με λιγότερες ασθένειες και ένα μεγαλύτερο «healthspan». Η υποκείμενη αρχή που οδηγεί σε αυτό περιγράφεται από την ορμή και είναι το προϊόν των ανθρώπων που έχουν εξελιχθεί, μαζί με τα περισσότερα άλλα ζώα, σε ένα περιβάλλον όπου η προσαρμογή προκλήθηκε συνεχώς λόγω της ανάγκης μετακίνησης λόγο της λιγότερο διαθέσιμης τροφής. Ως φαινότυπος, τείνουν να έχουν μεγαλύτερη αναλογία μυϊκού λίπους και εάν υπάρχουν εμφανίζουν λίγα συμπτώματα του μεταβολικού συνδρόμου, όπως αυξημένο όγκο λίπους του ήπατος και σπλαγχνικό λιπώδη ιστό, αντίσταση στην ινσουλίνη ή δείκτες χρόνιας φλεγμονής. Σε αυτό το πλαίσιο, τα δεδομένα υποδηλώνουν ότι οι μύες, ως όργανο, τείνει να είναι αντιφλεγμονώδες όταν χρησιμοποιείται τακτικά, ενώ η λιπώδης ιστός είναι φλεγμονώδης εάν γίνει υπερφορτωμένος. Καθώς ο ιός φαίνεται να προκαλεί οξειδωτικό στρες [164] και αερόβια γλυκόλυση για να ενισχύσει τη δική του αναπαραγωγή, θα μπορούσε να υποστηριχθεί ότι σε ένα άτομο με ανεπαρκή μιτοχονδριακό και αντιοξειδωτικό αποθεματικό, η μόλυνση θα τείνει να οδηγεί σε χρόνια φλεγμονή και ελλιπή επίλυση. Σε αυτό το σενάριο, είναι σημαντικό να καταστέλλουμε είτε τη φλεγμονή μόνη της, είτε να παρέχουμε επιπλέον αντιοξειδωτική ισχύ για να μειώσουμε την πιθανότητα φλεγμονής.
14. Μιτοχονδριακή λειτουργία και θεραπευτική στρατηγική
Όπως καθίσταται σαφές, η διατήρηση της καλής υγείας, ιδίως, τα βέλτιστα επίπεδα αερόβιας φυσικής κατάστασης και η ισορροπία μυών / λίπους είναι μια καλή προληπτική στρατηγική, και στην πραγματικότητα, τα αποτελέσματα της ζωής ενός υγιεινού τρόπου ζωής.
Μια αναδρομική μελέτη μετά το ξέσπασμα της γρίπης του Χονγκ Κονγκ το 2008 διαπίστωσε ότι η σωματική δραστηριότητα ήταν προστατευτική και εμφάνισε μια καμπύλη δόσης-απόκρισης σε σχήμα «U» [165].
Η υψηλή αερόβια φυσική κατάσταση σχετίζεται με μειωμένη νοσηρότητα και θνησιμότητα [166,167] και η σωματική δραστηριότητα, αν όχι υπερβολική, είναι γενικά αντιφλεγμονώδης μακροπρόθεσμα [15,168] και οδηγεί σε αυξημένη αντιοξειδωτική κατάσταση [169].
Ομοίως, ο περιορισμός των θερμίδων, που σχετίζεται με βελτιωμένη διάρκεια ζωής, είναι επίσης αντιφλεγμονώδης [170,171], όπως και μια δίαιτα με υψηλή περιεκτικότητα σε πολυφαινόλες και προβιοτικά [172].
Ωστόσο, εξακολουθούν να υπάρχουν πολλοί άνθρωποι, οι οποίοι, για διάφορους λόγους, δεν ζουν έναν ιδιαίτερα υγιεινό τρόπο ζωής – τα αποτελέσματα των οποίων επιδεινώνονται με την ηλικία.
Αυτό, λοιπόν, εγείρει το ερώτημα, θα μπορούσε η ενίσχυση / υποστήριξη των μιτοχονδριακών υγειονομικών βοηθειών σε αυτόν τον πληθυσμό εάν μολυνθούν και θα κατανοούσε τον ρόλο των μιτοχονδρίων στη λήψη αποφάσεων για τη θεραπεία;
Υπάρχουν πολλές δυνατότητες, που κυμαίνονται από την καταστολή του αυτοφλεγμονώδους βρόχου (π.χ. άμεση στόχευση φλεγμονωδών οδών, με, για παράδειγμα αντισώματα ή αναστολείς κινάσης), έως την προστασία των μιτοχονδρίων, την ενίσχυση του μιτοχονδριακού κύκλου εργασιών και την ανανέωση και την προετοιμασία, έως την άμεση διαχείριση redox. Στην πραγματικότητα, φαίνεται ότι πολλά καθιερωμένα φάρμακα πιθανώς ήδη διαμορφώνουν τη μιτοχονδριακή λειτουργία, η οποία μπορεί να μας δώσει μια περαιτέρω εικόνα.
Η άλλη κύρια στρατηγική και ίσως με το μεγαλύτερο πιθανό προληπτικό όφελος μακροπρόθεσμα, είναι ο εμβολιασμός. Οι επιπτώσεις της μιτοχονδριακής υγείας εδώ θα μπορούσαν να είναι εξαιρετικά σημαντικές για το εάν ένα εμβόλιο είναι επιτυχές σε συγκεκριμένους πληθυσμούς, για παράδειγμα τους ηλικιωμένους και εκείνους με συννοσηρότητα.
15. Επαναπροσδιορισμός φαρμάκων
Πολλές από τις ενώσεις που μελετώνται τώρα μπορούν να επηρεάσουν τη μιτοχονδριακή λειτουργία. Για παράδειγμα, η έρευνα για την ανοσορρύθμιση κατά τη διάρκεια λοιμώξεων της γρίπης εξέτασε κορτικοστεροειδή, αγωνιστές ενεργοποιημένων υποδοχέων υπεροξεισωμάτων (PPAR), αναστολείς κυκλοοξυγενάσης (COX), ενεργοποιητές μονοφωσφορικής κινάσης αδενοσίνης (AMPK), άμεσα αντιοξειδωτικά και φυσικά προϊόντα [173].
Όλα αυτά μπορούν να ρυθμίσουν τη μιτοχονδριακή λειτουργία [174,175,176,177,178]. Τα μη στεροειδή αντιφλεγμονώδη φάρμακα (ΜΣΑΦ) γενικά, σε διάφορους βαθμούς, επηρεάζουν τη μιτοχονδριακή λειτουργία [179].
Η επαναπροσαρμογή φαρμάκων προσδιόρισε πρόσφατα μεταξύ άλλων αρκετούς υποψηφίους, όπως η ιρβεσαρτάνη, η παροξετίνη, το σιρόλιμους, η μελατονίνη και η κινακρίνη [180].
Έχει προταθεί ότι οι αναστολείς των υποδοχέων της αγγειοτασίνης (ARBs) είναι μιτοχονδριακά προστατευτικοί [181], ενώ τα αντικαταθλιπτικά, όπως η παροξετίνη, μπορούν να αναστέλλουν τη μιτοχονδριακή λειτουργία [182].
Το Sirolimus, ή η ραπαμυκίνη, είναι στην πραγματικότητα ένα από τα καλύτερα μελετημένα μιμητικά περιορισμού θερμίδων καθώς ρυθμίζει τον στόχο της ραπαμυκίνης των θηλαστικών (mTOR).
Είναι αντιφλεγμονώδες και ρυθμίζει τη μιτοχονδριακή λειτουργία και θα μπορούσε να διαδραματίσει βασικό ρόλο στη mitohormesis [183]. Μπορεί, στην πραγματικότητα, να αυξήσει τη μιτοχονδριακή αναπνοή και να μειώσει την παραγωγή υπεροξειδίου του υδρογόνου [184].
Τα δεδομένα υποδηλώνουν ότι αυτός ο νέος ιός μπορεί πράγματι να αναστείλει την αυτοφαγία και το μονοπάτι mTOR [121]. Αυτό μπορεί να υποδηλώνει ότι μπορεί να βελτιώσει την παραγωγή ATP μειώνοντας ταυτόχρονα τα ROS, το οποίο θα το ωφελούσε (τουλάχιστον, αρχικά, καταστέλλοντας την ανοσολογική ενεργοποίηση).
Συνολικά, θα μπορούσε να υποστηριχθεί ότι οι ενώσεις που αναστέλλουν τη μιτοχονδριακή λειτουργία μπορεί να έχουν μια σειρά επιδράσεων, όπως η πρόκληση mitohormesis, ενεργοποιώντας έτσι τον μιτοχονδριακό κύκλο εργασιών και την ανανέωση, αλλά θα μπορούσαν επίσης να απενεργοποιήσουν τη μιτοχονδριακή υποστήριξη για την αναπαραγωγή του ιού, και ίσως, να ενισχύσουν την απόπτωση. Ωστόσο, αυτό πρέπει να εξισορροπηθεί με την πιθανότητα να προκαλέσουν υπερβολική ζημιά και, ενδεχομένως, να επιδεινώσουν την κατάσταση.
Μία ομάδα φαρμάκων που έχουν ερευνηθεί ως πιθανή θεραπεία για SARs-CoV-2 είναι οι ανθελονοσιακές αμινοκινολόνες, οι οποίες έχουν διερευνηθεί εδώ και δεκαετίες ως ανοσορυθμιστές και αντιιικά.
Ο βασικός τρόπος δράσης τους περιλαμβάνει τη δέσμευση πρωτονίων και την αποξίνωση του λυσοσωμικού / ενδοσωματικού διαμερίσματος, το οποίο παρεμβαίνει στην αντιγραφή του ιού, στην αυτοφαγία και στις φλεγμονώδεις οδούς, αλλά επηρεάζουν επίσης τη μεμβράνη του πλάσματος, τις κινάσες MAP, τη σηματοδότηση ασβεστίου, καθώς και το DNA [185].
Μπορούν επίσης να ρυθμίσουν τη μιτοχονδριακή λειτουργία [186, 187,188] και έχουν αποδειχθεί ότι έχουν αντιοξειδωτική δράση [189]. Παραδόξως, μπορούν επίσης να προκαλέσουν οξειδωτικό στρες, το οποίο έχει προκαλέσει ανησυχίες σχετικά με τη χρήση τους στη θεραπεία COVID-19 λόγω της υποξίας που σχετίζεται με το σύνδρομο οξείας αναπνευστικής δυσχέρειας (ARDS).
Ένας προτεινόμενος μηχανισμός είναι η αύξηση του ROS που δημιουργείται από τα μιτοχόνδρια – καθώς και πιθανές άμεσες επιπτώσεις στα μιτοχόνδρια [190]. Μια μετα-ανάλυση έδειξε ότι η υδροξυχλωροκίνη που χρησιμοποιήθηκε στη θεραπεία του COVID-19 είχε ως αποτέλεσμα 2,5 φορές μεγαλύτερη θνησιμότητα σε σύγκριση με τις ομάδες ελέγχου, ενώ η χρήση της συσχετίστηκε με 1,2 φορές βελτίωση σε ασθενείς με ήπια έως μέτρια συμπτώματα σε σύγκριση με μια ομάδα ελέγχου [191].
Μια μελέτη φαρμακοεπαγρύπνησης διαπίστωσε επίσης ότι η χρήση υδροχλωροκίνης / χλωροκίνης για τη θεραπεία του COVID19 συσχετίστηκε με υψηλότερα ποσοστά καρδιαγγειακών παρενεργειών [192].
Είναι ενδιαφέρον, σε μια άλλη μελέτη, αν και η υδροξυχλωροκίνη και η χλωροκίνη δεν συσχετίστηκαν με καμία σημαντική επίδραση στη θνησιμότητα, η υδροξυχλωροκίνη, αλλά όχι η χλωροκίνη, συσχετίστηκε με σημαντική μείωση της μεταφοράς στη μονάδα εντατικής θεραπείας των ασθενών που εισήχθησαν στο νοσοκομείο [193].
Μια πρόσφατη ανασκόπηση της βιβλιογραφίας δείχνει ότι αυτά τα μόρια έχουν διφασικά / ορμητικά αποτελέσματα σε πολλά μοντέλα, για παράδειγμα, μπορούν να διεγείρουν ή να αναστέλλουν την ανάπτυξη καρκινικών κυττάρων και ιών ανάλογα με τη δόση [194] Αυτό όχι μόνο τονίζει το ρόλο της δόσης, αλλά επίσης, ενδεχομένως, την επαγωγή οξειδωτικού στρες και την υποκείμενη υγεία του ασθενούς, και εάν αυτές οι ενώσεις αυξάνουν τον κίνδυνο ή το όφελος.
Ένα άλλο πολύ παλιό αντιφλεγμονώδες φάρμακο, η κολχικίνη, διερευνάται επίσης για την αποτελεσματικότητα σε ασθενείς με COVID-19, καθώς φαίνεται να αναστέλλει το φλεγμονώδες NLRP3, ίσως καταστέλλοντας τη μεταφορά μιτοχονδρίων [195].
Είναι ενδιαφέρον ότι, ο SARs-CoV-2 φαίνεται ότι ρυθμίζει πολλές πρωτεΐνες που σχετίζονται με τον κυτταροσκελετό και μπορεί να προκαλέσει φιλμικές προεξοχές [94]. Η κολχικίνη χρησιμοποιείται συχνά για τη μελέτη της αυτοφαγίας, καθώς αποπολώνει τους μικροσωληνίσκους, αναστέλλοντας έτσι τη διαδικασία.
Έχει πλέον αποδειχθεί ότι μπορεί να οδηγήσει σε βλάβες στη σκελετική μιτοχονδριακή λειτουργία, στην αύξηση του ROS και σε μεγαλύτερα ζώα, αυτό μπορεί να οδηγήσει σε αντίσταση στην ινσουλίνη [196].
Όλα αυτά υποδηλώνουν ότι πολλά από αυτά τα φάρμακα, ειδικά εκείνα που μπορεί να επηρεάσουν τη μιτοχονδριακή λειτουργία, είτε άμεσα είτε έμμεσα, και θα μπορούσαν να έχουν μια εξαρτώμενη από την ηλικία επίδραση – ειδικά εκείνα που μπορεί να επηρεάσουν την αυτοφαγία.
Μια σημαντική κατηγορία φαρμάκων είναι οι αναστολείς MAPK, πολλοί από τους οποίους έχουν αναπτυχθεί ως αντικαρκινικοί παράγοντες. Όπως αναφέρθηκε προηγουμένως, τα MAPK μπορούν να ρυθμίσουν τη μιτοχονδριακή λειτουργία.
Έχουν προταθεί ως πιθανές θεραπείες καθώς ο ιός φαίνεται να ρυθμίζει τη δραστηριότητα της ρ38 και να αναστέλλει τις αντιρυθμιστικές οδούς. Αν και αυτό μπορεί να βοηθήσει στην αντιγραφή του ιού, μπορεί επίσης να οδηγήσει σε υπερβολική φλεγμονή σε ορισμένους ασθενείς [197,198]. Ε
Είναι ενδιαφέρον ότι η βεμουραφενίμπη, ένας αναστολέας του ΜΑΡΚ, έχει αποδειχθεί ότι αναστέλλει τη φωσφορυλίωση της πρωτεΐνης 1 που σχετίζεται με τη Dynamin (DRP1), αναστρέφοντας την υπερβολική μιτοχονδριακή σχάση σε κύτταρα μελανώματος και έχει ως αποτέλεσμα υπερσύντηξη και ενίσχυση της οξειδωτικής φωσφορυλίωσης και αναστροφή της αερόβιας γλυκόλυσης [199].
Αυτό υπογραμμίζει και πάλι τις παραλληλότητες μεταξύ καρκίνου και ιογενούς λοίμωξης με την έννοια ότι και οι δύο προκαλούν εκτεταμένο μεταβολικό αναπρογραμματισμό και χειρισμό του κυτταρικού κύκλου, συχνά προς την αερόβια γλυκόλυση με ρύθμιση της μιτοχονδριακής λειτουργίας, καθώς και εξασθένιση/τροποποίηση της ανοσοαπόκρισης.
Τα δεδομένα υποδηλώνουν επίσης ότι οι αναστολείς της κυκλοφιλίνης, όπως η κυκλοσπορίνη Α, οι οποίοι εκτός του ότι είναι κατασταλτικοί του ανοσοποιητικού συστήματος, θα μπορούσαν επίσης να αναστέλλουν την αντιγραφή των σχετικών ιών corona virus.
Τα δεδομένα έχουν ήδη δείξει ότι ορισμένοι ασθενείς με μεταμόσχευση που λαμβάνουν ανοσοκατασταλτικά φαίνεται να έχουν κάποια προστασία έναντι του ιού, αν και αυτές ήταν μελέτες παρατήρησης και άλλοι παράγοντες, όπως η καλή υγιεινή, θα μπορούσαν να είναι σημαντικοί.
Όμως, τα δεδομένα in vitro υπαινίσσονται την αποτελεσματικότητα, ειδικά σε άλλους ιούς corona, όπως το κοροναϊό του αναπνευστικού συνδρόμου της Μέσης Ανατολής (MERS), όπως και τα στοιχεία σχετικά με τη σημασία των κυκλοφιλινών στην ενίσχυση του ιού.
Ο τρόπος δράσης θεωρείται ότι συνεπάγεται αναστολή της καλσινευρίνης και καταστολή του πυρηνικού παράγοντα των ενεργοποιημένων Τ κυττάρων (NFAT) (αναθεωρήθηκε στο [200]). Σε ποντίκια που έχουν μολυνθεί με MERS-CoV, φαίνεται ότι η κυκλοσπορίνη προκαλεί μια ισχυρή απόκριση ιντερφερόνης γάμμα, η οποία σχετίζεται με την αναστολή της αντιγραφής και της απελευθέρωσης του ιού [201].
Τα MAVs είναι ένα βασικό συστατικό της αντοχής σε ιούς, και μπορεί να ενεργοποιήσει και τις δύο οδούς δηλαδή ιντερφερόνη και NF-kB, θέτοντας στο επίκεντρο τα μιτοχόνδρια έναντι της ιικής άμυνας [202].
Τα δεδομένα δείχνουν ότι οι ανοσοφιλίνες είναι ρυθμιστές των MAVs [203,204]. Δεδομένης της σημασίας της κυκλοφιλίνης D, ένας πολύ γνωστός στόχος της κυκλοσπορίνης που ρυθμίζει τη μετάβαση της διαπερατότητας των μιτοχονδρίων [205], θα ήταν ενδιαφέρον να υποθέσουμε ότι εκτός από τους καλά περιγραφόμενους στόχους ανοσοφιλίνης των ενώσεων όπως η τακρόλιμους και η κυκλοσπορίνη, δεν μπορεί να αποκλειστεί ένας ρόλος για τη διαμόρφωση των μιτοχονδρίων.
Υπό αυτό το πρίσμα, η αποτελεσματικότητα του αναστολέα της πανκυκλοφιλίνης, της Αλισποβίρης, η οποία δεν έχει ανοσοκατασταλτικά αποτελέσματα, είναι δυνητικά ενδιαφέρουσα καθώς έχει υψηλή ισχύ έναντι του SARS-CoV-2. Έχει προταθεί ότι η ικανότητά του να αναστέλλει την κυκλοφιλίνη D και επομένως να ελέγχει τη διαπερατότητα των μιτοχονδρίων, ίσως είναι σημαντική για την πρόληψη της βλάβης των πνευμόνων [206].
Τέλος, μερικά πολύ ελπιδοφόρα προκαταρκτικά δεδομένα από τη δοκιμή RECOVERY υποδηλώνουν ότι η χαμηλή δόση δεξαμεθαζόνης θα μπορούσε να βοηθήσει στην πρόληψη του θανάτου έως και 30% των διασωληνομένων ασθενών [207].
Στις 18 Σεπτεμβρίου 2020, ο Ευρωπαϊκός Οργανισμός Φαρμάκων ενέκρινε τη χρήση δεξαμεθαζόνης σε ασθενείς με COVID-19 με οξυγόνο ή μηχανική αναπνευστική υποστήριξη (EMA / 483739/2020).
Η πιο γνωστή επίδραση των γλυκοκορτικοειδών είναι η καταστολή της φλεγμονής, κυρίως μέσω του υποδοχέα γλυκοκορτικοειδών (GR), αλλά σε χρόνια χρήση έχουν παρενέργειες, καθώς είναι καταβολικές [208]].
Το βασικό σημείο εδώ είναι ότι τα γλυκοκορτικοειδή γενικά προκαλούνται από στρες, και βραχυπρόθεσμα, είναι εξαιρετικά προστατευτικά. Είναι επομένως σχετικό ότι οι GR μεταφέρουν επίσης στο μιτοχόνδριο και ελέγχουν τη μεταγραφή του μιτοχονδριακού γονιδίου και έχουν διφασικές δράσεις [209].
Είναι επομένως σχετικό ότι η δεξαμεθαζόνη έχει αποδειχθεί ότι προκαλεί αμφότερες τη μιτοχονδριακή αποσύνδεση και αυξάνει την οξειδωτική φωσφορυλίωση [210], αλλά επίσης προκαλεί μιτοχονδριακή δυσλειτουργία [211].
Αυτό δεν προκαλεί έκπληξη, καθώς τα μιτοχόνδρια είναι κεντρικά τόσο στη βιοσύνθεση όσο και στη δράση των στεροειδών, και, συνεπώς, στη διαχείριση του στρες [174]]. Αν και μπορεί να θεωρηθεί ότι το κυρίαρχο αποτέλεσμα στη δοκιμή RECOVERY είναι μέσω της άμεσης καταστολής των φλεγμονωδών οδών, δεν είναι αδύνατο να μην αποκλείονται οι επιπτώσεις στα μιτοχόνδρια.
16. Αντιοξειδωτικά και φυσικά προϊόντα
Μια περαιτέρω προσέγγιση που έχει προταθεί είναι η καταστολή του οξειδωτικού στρες με τη χρήση ενώσεων που είναι αντιοξειδωτικά.
Άμεσα αντι-οξειδωτικά, για παράδειγμα Ν-ακετυλο κυστεΐνη, η οποία, παρόλο που έχει δείξει κάποια αποτελεσματικότητα, αντιμετώπισε περιορισμένη επιτυχία λόγω προβλημάτων δόσης [212].
Ωστόσο, η βιταμίνη C, η οποία είναι πλέον γνωστό ότι συγκεντρώνεται στα μιτοχόνδρια και δρα ως καθαριστής ROS [213], θα μπορούσε να είναι χρήσιμη. Μια αναδρομική ανάλυση δεδομένων έχει δείξει ότι η βιταμίνη C μπορεί να μειώσει τόσο το χρόνο στη μονάδα εντατικής θεραπείας όσο και το χρόνο στους αναπνευστήρες, ιδιαίτερα για πολύ άρρωστους ασθενείς [214,215].
Τώρα προτείνεται ότι χρησιμοποιείται σε συνδυασμό με κερσετίνη, η οποία φαίνεται επίσης να έχει αποτελεσματικότητα σε ιογενείς λοιμώξεις [216]: η κερσετίνη είναι ένα φυσικό προϊόν που έχει αντιοξειδωτικές ιδιότητες και συμπυκνώνεται στα μιτοχόνδρια και μπορεί να προκαλέσει μιτοχονδριακή βιογένεση [217,218].
Μια άλλη σημαντική αρχή είναι ότι πολλές φυτικές ενώσεις φαίνεται ότι έχουν αντι-ιικές ιδιότητες, καθώς και αντικαρκινικές ιδιότητες, και ρυθμίζουν τη σηματοδότηση ασβεστίου και τη μιτοχονδριακή λειτουργία – με κοινούς στόχους, όπως το VDAC.
Τα φυτά πάσχουν τόσο από ιογενή λοίμωξη όσο και από καρκίνο, οπότε θα μπορούσε να υπάρχει κάποια διασταύρωση σε λειτουργία από φυτά σε ζώα [219]. Καθώς οι ιοί φαίνεται να παραβιάζουν τη λειτουργία των κυτταρικών οργανιδίων του ξενιστή τους, συμπεριλαμβανομένης των μιτοχονδρίων, τότε η μερική αναστολή της μιτοχονδριακής λειτουργίας θα μπορούσε να είναι μια εξελιγμένη στρατηγική για να νικήσει τον ιό, ειδικά εάν προκαλεί απόπτωση και / ή αυξάνει τη μιτοφάγο και τα μιτοχονδριακά συστήματα ανανέωσης και αντιοξειδωτικών.
Ένα καλό παράδειγμα αυτού είναι ίσως το σαλικυλικό οξύ, το οποίο είναι μια σημαντική ένωση σηματοδότησης φυτικής άμυνας [220] και ρυθμίζει τη μιτοχονδριακή λειτουργία, αναστέλλοντας την αλυσίδα μεταφοράς ηλεκτρονίων και ενεργώντας ως παράγοντας αποσύνδεσης [221,222], καθώς και ρυθμίζοντας την έκφραση VDAC [223].
Μερικοί ιοί των φυτών παράγουν πρωτεΐνες που μπορούν να αναστέλλουν την οξειδωτική έκρηξη και την αυτοφαγία που εξαρτάται από το σαλικυκλικό οξύ [224]. Υπάρχει επομένως, δυνητικά, χρήσιμη εικόνα από την παρατήρηση ότι ορισμένα φάρμακα που προέρχονται από φυτικές (ή άλλες οργανικές) αμυντικές ενώσεις, φαίνεται επίσης να έχουν κάποιο όφελος στις ανθρώπινες ιογενείς λοιμώξεις. Πράγματι, ο Gurbel και οι συνάδελφοί του έχουν προτείνει ότι η ασπιρίνη θα μπορούσε να χρησιμοποιηθεί έναντι του SARS-CoV-2, για παράδειγμα, μειώνοντας την ενεργοποίηση του NF-κB [ 225].
Υπάρχει επίσης ενδιαφέρον για την πιθανότητα ενώσεων όπως η κανναβιδιόλη (CBD) να βοηθήσουν τους ασθενείς με COVID-19, καθώς τα κανναβινοειδή φαίνεται να έχουν κάποια αντι-ιική δραστηριότητα και είναι αντιοξειδωτικά και αντιφλεγμονώδη [226].
Η CBD, μεταξύ των πολλών προσδιορισμένων στόχων της [227], φαίνεται να ρυθμίζει άμεσα τη λειτουργία των μιτοχονδρίων, για παράδειγμα, έχει αποδειχθεί ότι συνδέεται με το VDAC1 και αναστέλλει την αλυσίδα μεταφοράς ηλεκτρονίων [228,229]. Υπάρχουν επίσης ενδείξεις ότι μπορεί να αναστείλει την ενεργοποίηση του φλεγμονώματος [230].
Ένας βασικός μηχανισμός είναι ότι πολλές φυτικές ενώσεις ενεργοποιούν το Nrf2 και επομένως είναι ορμονικές [231]. Επιπλέον, καθώς πολλά χημικά παραγόμενα φάρμακα αναπτύχθηκαν από αμυντικές ενώσεις που βρέθηκαν σε φυτά και άλλους οργανισμούς. Ένα άλλο παράδειγμα αυτού θα μπορούσε να είναι οι στατίνες, οι οποίες αναστέλλουν επίσης τη μιτοχονδριακή λειτουργία [232,233,234], και μια μελέτη έδειξε ότι μπορούν να μειώσουν τη θνησιμότητα των ασθενών με COVID-19 [235].
Ένα άλλο πανταχού παρόν αντιοξειδωτικό μόριο, η μελατονίνη, η οποία προστατεύει επίσης τα μιτοχόνδρια [236], διερευνάται επίσης ως επικουρικό για την προστασία από μια καταιγίδα κυτοκίνης σε λοίμωξη SARs-CoV-2 [237].
Είναι ενδιαφέρον πως έχει αποδειχθεί ότι αναστρέφει το φαινόμενο Warburg σε ανοσοκύτταρα και πιθανόν να έχει αντιφλεγμονώδη δράση και να δικαιολογεί τη χρήση του σε ασθενείς με COVID-19 [92]. Ομοίως, η γλουταθειόνη φαίνεται να βοηθά στην αποκατάσταση της ανισορροπίας Th1 / Th2 που σχετίζεται με την ηλικία [ 160].
Δυνητικής σημασίας είναι η παρατήρηση ότι ένα τροποποιημένο παράγωγο βιταμίνης Ε που συγκεντρώνεται στα μιτοχόνδρια έχει δείξει οφέλη σε ένα μοντέλο καρδιακής φλεγμονής που προκαλείται από σήψη. Φαίνεται ότι το κάνει αυτό καταστέλλοντας τη βλάβη του μιτοχονδριακού DNA και την επακόλουθη απελευθέρωσή του [238]. Το mtDNA είναι ισχυρός ενεργοποιητής του φλεγμονώδους συστήματος [239 ].
Επίσης ενδιαφέρει εδώ η βιταμίνη D, η οποία έχει προταθεί ως πιθανή ανοσοενισχυτική θεραπεία για ασθενείς με τον ιό, καθώς μπορεί να αποκαταστήσει την ανοσοποιητική λειτουργία.
Συγκεκριμένα, μπορεί να ενισχύσει την παραγωγή αντιφλεγμονώδους κυτοκίνης και έτσι να περιορίσει την πιθανότητα καταιγίδας κυτοκίνης. Οι αναλύσεις φαίνεται να δείχνουν ότι μπορεί να έχει κάποιο όφελος σε άτομα που έχουν χαμηλά επίπεδα αυτής της βιταμίνης [240]. Ρυθμίζει τη μιτοχονδριακή λειτουργία, έχοντας ποικίλες επιδράσεις ανάλογα με τον ιστό.
Μπορεί να διεγείρει τη μιτοχονδριακή λειτουργία των μυών [241], αλλά μπορεί επίσης να ενισχύσει την αποθήκευση των λιπιδίων και την λιπογένεση [242]. Είναι ενδιαφέρον ότι έχει προταθεί ότι η νοσηρότητα της COVID-19 αυξάνεται με το βόρειο πλάτος, υποδηλώνοντας μια σύνδεση με το υπεριώδες φως και τη βιταμίνη D [243].
Η βιταμίνη Β3 έχει επίσης αποδειχθεί ότι έχει κάποια προστατευτική δράση σε μοντέλα μιτοχονδριακής μυοπάθειας [244], και έχει προταθεί ότι θα μπορούσε να βοηθήσει στην πρόληψη τραυματισμού των πνευμόνων σε ασθενείς με COVID-19 [245].
Τέλος, τα τεχνητά μιτοχονδριακά αντιοξειδωτικά μόρια, όπως το MitoQ και το SKQ1 θα μπορούσαν επίσης να προσφέρουν οφέλη [246].
Υπάρχουν επίσης ενώσεις όπως τα παράγωγα Luminol, τα οποία γίνονται καθαριστές ROS μόνο σε περιοχές με υψηλό οξειδωτικό στρες και δείχνουν κάποια υπόσχεση για τη ρύθμιση της φλεγμονής που προκαλείται από την οξειδοαναγωγική δραστηριότητα [247,248,249]. Ωστόσο, σε αντίθεση με τα MitoQ και SKQ1, είναι πιθανό οι ενώσεις που μοιάζουν με Luminol να δρουν έξω από το μιτοχόνδριο [250].
17. Εμβολιασμός
Η ηλικιακή μείωση της ανοσολογικής λειτουργίας περιγράφεται καλά, αν και δεν είναι καλά κατανοητή, και επηρεάζει σχεδόν όλα τα συστατικά και έχει μεγάλο αντίκτυπο στην επιτυχία του εμβολιασμού – η οποία οδήγησε σε μια συνεχή προσπάθεια βελτίωσης των εμβολίων για την παλαιότερη γενιά, ιδίως κατά της γρίπης [251].
Ωστόσο, αναγνωρίζεται ότι μπορεί να τροποποιηθεί από πολλούς παράγοντες, από την άσκηση έως το άγχος και τις χρόνιες λοιμώξεις [252]. Κρίσιμη σε αυτές τις αποκρίσεις είναι η μεταβολική ευελιξία, για παράδειγμα, η ικανότητα εναλλαγής μεταξύ οξειδωτικής φωσφορυλίωσης και γλυκόλυσης, και πώς αυτό επηρεάζει διαφορετικούς υποπληθυσμούς κυττάρων και την προφλεγμονώδη / αντιφλεγμονώδη ισορροπία.
Για παράδειγμα, τα ηλικιωμένα Β-κύτταρα χάνουν την ικανότητα οξειδωτικής φωσφορυλίωσης και βασίζονται περισσότερο στη γλυκόλυση και παράγουν περισσότερο ROS.
Επίσης διεισδύουν στον λιπώδη ιστό, αυξάνοντας τη φλεγμονή σε μια διαδικασία που περιλαμβάνει το φλεγμονώδες NLRP3. Σε σχέση με την απόκριση Β-κυττάρου, που είναι βασικός σκοπός του εμβολιασμού, φαίνεται ότι η παχυσαρκία και το μεταβολικό σύνδρομο, επιταχύνει την ανοσοεκφυλισμό και μειώνει την ικανότητα παραγωγής αντισωμάτων [253].
Ένας πρωταρχικός τομέας έρευνας είναι η ανάπτυξη εμβολίων για τους ηλικιωμένους κατά της γρίπης. κατά μέσο όρο, σε ηλικία άνω των 65 ετών, η αποτελεσματικότητα μειώνεται γρήγορα.
Για να μελετηθεί αυτό, οι δείκτες που σχετίζονται με την ανοσοαπόκριση στο αίμα έχουν συσχετιστεί με το αποτέλεσμα. Είναι ενδιαφέρον ότι οι αποκρίσεις Τ-κυττάρων βρέθηκε ότι είναι ισχυρότεροι συσχετισμοί προστασίας από τα αντισώματα.
Αν και η βιολογία είναι εξαιρετικά περίπλοκη και μπορεί να απαιτεί προσέγγιση «εμβολιονομικής» σε επίπεδο συστήματος, ο δυσρυθμιζόμενος μεταβολισμός είναι σαφώς μέρος του προβλήματος – και έχει προταθεί ότι μπορεί να απαιτηθούν θεραπείες για τη διόρθωση δυσρυθμιζόμενων μεταβολικών ή άλλων φυσιολογικών διαδικασιών πριν από τη χορήγηση εμβολίων [254].
Φαίνεται λοιπόν ότι για να βελτιωθεί η αποτελεσματικότητα των εμβολίων, είναι είτε απαραίτητο να προσαρμοστεί το εμβόλιο στο συγκεκριμένο προφίλ ανοσοεκφυλισμού που δείχνει ένας ασθενής ή, ίσως να μειώσει την επιγενετική του ηλικία διασφαλίζοντας ότι ζουν έναν υγιή τρόπο ζωής και έτσι ενισχύουν ανοσοποιητικό σύστημα.
18. Επιπτώσεις της διαμόρφωσης από τον SARs-CoV-2 της μιτοχονδριακής λειτουργίας
Υπάρχουν πολλοί παράγοντες που πρέπει να λαμβάνονται υπόψη από αυτό. Εάν, όπως φαίνεται να συμβαίνει, αυτός ο ιός ρυθμίζει τη μιτοχονδριακή λειτουργία, και έτσι, η μιτοχονδριακή υγεία είναι σημαντική, υπάρχουν πολλές ενδιαφέρουσες δυνατότητες.
Η μιτοχονδριακή λειτουργία εξηγεί γιατί η νοσηρότητα μπορεί να είναι μεγαλύτερη στους άνδρες από ότι στις γυναίκες;
Υπάρχουν προφανώς παραπλανητικοί παράγοντες συμπεριφοράς, αλλά στατιστικά, οι άνδρες φαίνεται να έχουν υψηλότερα ποσοστά θνησιμότητας από τις γυναίκες όταν μολύνονται με τον κοροναϊό [255, 256]. Τα μιτοχόνδρια στις γυναίκες μπορεί να είναι πιο ανθεκτικά, κάτι που θα μπορούσε να εξηγήσει γιατί οι γυναίκες τείνουν να ζουν περισσότερο από τους άντρες [257].
Ρύπανση, μιτοχόνδρια και σοβαρότητα
Η ρύπανση θα μείωνε την αντίσταση στον ιό; Το διοξείδιο του αζώτου είναι οξειδωτικό και μπορεί να προκαλέσει πνευμονική φλεγμονή και να μειώσει τη λειτουργία [258], να οξειδώσει το μιτοχονδριακό κυτόχρωμα C [259], ενώ η οξεία εισπνοή μπορεί να προκαλέσει μιτοχονδριακή δυσλειτουργία στον εγκέφαλο [260].
Τα στοιχεία από το Ηνωμένο Βασίλειο δείχνουν τώρα ότι τα υψηλά επίπεδα ρύπανσης συνδέονται με την αυξημένη θνησιμότητα COVID-19 [261]. Συνδεδεμένο με αυτό είναι η πολύ ανησυχητική ένδειξη ότι τα πλούσια σε σίδηρο νανοσωματίδια, τα οποία προέρχονται σε μεγάλο βαθμό από μηχανοκίνητα οχήματα, βρίσκονται τώρα στα καρδιακά μιτοχόνδρια στα πολύ νεαρά άτομα και προκαλούν οξειδωτικό στρες [262].
Το σύστημα ρενίνης-αγγειοτενσίνης-αλδοστερόνης (RAAS) και η μιτοχονδριακή λειτουργία
Ο κοροναϊός συνδέεται με το ACE2 [263,264 ] και τα μιτοχόνδρια έχουν το δικό τους σύστημα αγγειοτενσίνης [85]. Το ACE2 διασπά την αγγειοτασίνη II για να παράγει αντιφλεγμονώδη μόρια και προστατεύει τα μιτοχόνδρια [84,86].
Αυτό υποδηλώνει ότι οι πολυμορφισμοί ACE1 / 2 θα είναι ένας παράγοντας στην αντίδραση στον ιό [265]. Τα ARB, τα ACEi και οι στατίνες μπορούν να ενισχύσουν τη δραστηριότητα του ACE2. Ο ρόλος τους στη θεραπεία συζητείται κατά αυτόν τον τρόπο [266,267].
Υποξική-ισχαιμική βλάβη επανέγχυσης και οξυγόνο
Κατά τη διάρκεια της υποξίας, η μιτοχονδριακή λειτουργία αναστέλλεται, αλλά στη συνέχεια γίνεται πηγή ROS κατά την επαναιμάτωση.
Θα μπορούσε τα κατεστραμμένα μιτοχόνδρια στον πνεύμονα και / ή την καρδιά να οδηγήσουν σε επιδείνωση των συμπτωμάτων εάν δοθεί πάρα πολύ οξυγόνο σε έναν ασθενή; Αυτό είναι σαφώς ένα δύσκολο κλινικό αίνιγμα, αλλά προτείνει ότι το συμπληρωματικό οξυγόνο πρέπει να χρησιμοποιείται μόνο όταν είναι απολύτως απαραίτητο.
Ενώσεις όπως η μελατονίνη, η CBD και η κουρκουμίνη έχουν δείξει κάποια προστατευτικά αποτελέσματα σε μοντέλα ισχαιμικής επανέγχυσης [268, 269,270 ] – η κουρκουμίνη είναι ένας παράγοντας αποσύνδεσης [271]. Η CBD ρυθμίζει τα μιτοχόνδρια [228].
Το κλειδί σε αυτό είναι τα αναδυόμενα δεδομένα ότι η υποξική προετοιμασία απαιτεί μείωση της κινητικής δύναμης των μιτοχονδριακών πρωτονίων [272]. Η διαχείριση της αποσύνδεσης ETC είναι επομένως ζωτικής σημασίας για τον έλεγχο του οξειδωτικού στρες [273].
Τα PPAR μπορεί να διαδραματίσουν βασικό ρόλο στον έλεγχο της αποσύνδεσης [274]. Επιπλέον, υπάρχουν πολλές ενδείξεις ότι τα αναισθητικά μπορούν να ρυθμίσουν τη μιτοχονδριακή λειτουργία και θα μπορούσαν να παίξουν ρόλο τόσο στην προστασία πριν όσο και μετά την ισχαιμία, και μερικά μπορούν να δράσουν ως παράγοντες αποσύνδεσης [275,276,277] .
Φυτοχημικοί αναστολείς πρωτεϊνάσης του ιού και μιτοχόνδρια
Δύο πρόσφατες μελέτες σύνδεσης δομών έδειξαν ότι αρκετά φυτοχημικά θα μπορούσαν να αναστέλλουν την πρωτεάση SARs-CoV-2 [278,279]. Καθώς πολλά φυτοχημικά μπορούν επίσης να διαμορφώσουν τη μιτοχονδριακή λειτουργία όπως τα φλαβονοειδή (EC, EGCG, naringenin, hesperetin, anthocyanins), η ρεσβερατρόλη, κουρκουμίνη, σουλφοραφάνη, ελαιοευρωπαΐνη, λυκοπένιο κ.α. [280], και κυρίως εξελίχθηκαν για την προστασία του φυτού, θα μπορούσε να θεωρηθεί ότι είναι πολυλειτουργικά και διαμορφώνουν πολλαπλές οδούς για να επιτευχθεί αυτό.
Μακροπρόθεσμες επιπτώσεις – “long covid”
Καθίσταται σαφές ότι μετά την ανάρρωση από την πρωτογενή λοίμωξη με SARS-CoV-2, πολλοί άνθρωποι υποφέρουν από μακροχρόνιες επιπτώσεις, όπως κόπωση και προβλήματα ψυχικής υγείας, καθώς και πιο εμφανή πνευμονικά προβλήματα.
Αυτό είχε ως αποτέλεσμα τη δημιουργία μιας εθνικής κοινοπραξίας στο Ηνωμένο Βασίλειο και την έναρξη της μελέτης PHOSP-COVID για τη διερεύνηση των μακροπρόθεσμων επιπτώσεων στην υγεία αυτού του ιού (βλέπε https://www.phosp.org/ ) [281].
Μια πιθανή συνέπεια της ιογενούς λοίμωξης θα μπορούσε να είναι η μακροχρόνια μιτοχονδριακή δυσλειτουργία, η οποία θα μπορούσε να οδηγήσει σε μια ποικιλία συμπτωμάτων. Η μιτοχονδριακή λειτουργία, και η σχέση της με το σύνδρομο χρόνιας κόπωσης είναι ένα εκτεταμένο πεδίο έρυενας [282]. Αυτό υποστηρίχθηκε περαιτέρω από ενδείξεις μιτοχονδριακής δυσλειτουργίας σε PBMCs ατόμων με σύνδρομο χρόνιας κόπωσης [283].
Μπορούμε να ελέγξουμε την υπόθεση ότι μιτοχονδριακή υγεία = ανοσολογική υγεία και αυξημένη αντίσταση στον ιό;
Όσον αφορά τις δοκιμές ή/ και την αναζήτηση αποδεικτικών στοιχείων ότι τα μιτοχόνδρια θα μπορούσαν να βοηθήσουν στην εξήγηση ορισμένων από την παθοφυσιολογία αυτού του ιού, υπάρχουν διάφοροι πιθανοί τρόποι για να αναζητηθούν αυτήν τη σχέση, που κυμαίνεται από εργαστηριακές μελέτες έως μελέτες πληθυσμού.
Άμεση απόδειξη ότι το SARs-CoV-2 ρυθμίζει τη μιτοχονδριακή λειτουργία
Αυτή η εργασία θα μπορούσε να διεξαχθεί in vitro με καλλιεργημένα κύτταρα ή / και απομονωμένα μιτοχόνδρια παρασκευασμένα από μάρτυρες και μολυσμένα άτομα. Συγκεκριμένα, η χρήση απεικόνισης για αναζήτηση τοπικής προσαρμογής σε «εργοστάσια ιών».
Τρόπος ζωής και μιτοχονδριακή λειτουργία
Θα μπορούσε να προβλεφθεί ότι αυτοί οι πληθυσμοί που παρουσιάζουν τα χαμηλότερα επίπεδα βέλτιστης υγείας και τα υψηλότερα επίπεδα του μεταβολικού συνδρόμου και του «διαβήτη», θα δείξουν την υψηλότερη ευαισθησία.
Για παράδειγμα, μπορεί να είναι αποκαλυπτικό να αντιστοιχιστεί το ποσοστό θνησιμότητας της περίπτωσης στις τελευταίες τάσεις στην παχυσαρκία / διαβήτη αφού ληφθούν υπόψη οι απαραίτητοι συγχυτές [284]. Προς υποστήριξη αυτού, τα αναδυόμενα δεδομένα από τη Νέα Υόρκη σε σχέση με τη μόλυνση από SARS-CoV-2 είναι ότι η παχυσαρκία συσχετίζεται έντονα με κρίσιμη ασθένεια [9].
Αντίθετα, αυτοί οι πληθυσμοί που δείχνουν τα υψηλότερα επίπεδα φυσικής κατάστασης και λειτουργία θα είναι πιο ανθεκτικοί. Για παράδειγμα, η μέτρηση VO 2 max θα έδειχνε μια αντίστροφη σχέση με τη νοσηρότητα.
Κληρονομική μιτοχονδριακή δυσλειτουργία
Άτομα με γνωστή μιτοχονδριακή δυσλειτουργία είναι γνωστό ότι εμφανίζουν ανώμαλη ευαισθησία σε λοιμώξεις [25]. Υπάρχει σχέση μεταξύ μιτοχονδριακού απλότυπου και αντίστασης; Υπάρχουν σίγουρα στοιχεία για διαφορετικούς απλότυπους mtDNA μεταξύ διαφορετικών πληθυσμών [285]. Αν και υπάρχει μια αναδυόμενη ανισότητα στη νοσηρότητα μεταξύ των Μαύρων και των άλλων μειονοτήτων στις ΗΠΑ, πιστεύεται ότι μπορεί να σχετίζεται περισσότερο με τις κοινωνικοοικονομικές ανισορροπίες και τα υψηλότερα ποσοστά συν-νοσηρότητας που προκαλούνται από τον τρόπο ζωής [286].
Δείκτες μιτοχονδριακής υγείας στο αίμα
Μιτοχονδριακοί δείκτες μειωμένης λειτουργίας που προέρχονται από το αίμα μπορεί να συσχετίζονται με τη σοβαρότητα της νόσου πριν, κατά τη διάρκεια και μετά τη μόλυνση.
Επιγενετική ηλικία και μιτοχονδριακή λειτουργία
Τα δεδομένα δείχνουν τώρα ότι είναι δυνατόν να προσδιοριστεί η επιγενετική ηλικία κάποιου και να το συγκριθεί με τη χρονολογική του ηλικία. Υπάρχει στενή συσχέτιση με αυτήν την αναλογία και συνυπάρχουσα νοσηρότητα [287]. Έτσι, οι προγενετικοί δείκτες μεταβολικής ηλικίας που προέρχονται από το αίμα συσχετίζονται με τη σοβαρότητα της νόσου πριν, κατά τη διάρκεια και μετά τη μόλυνση.
Συμπέρασμα
Το κύριο συμπέρασμα από αυτήν την ανασκόπηση είναι ότι καθώς η ανοσολογική λειτουργία εξαρτάται από τη μιτοχονδριακή λειτουργία, και παρόλο που αυτό μειώνεται με την ηλικία, ο ρυθμός που το κάνει μπορεί να τροποποιηθεί από τον τρόπο ζωής. Αυτό ίσως τονίζεται καλύτερα από τη σχέση μεταξύ γήρανσης, μιτοχονδριακής λειτουργίας και μεταβολικού συνδρόμου. Αυτό σημαίνει ότι τόσο η αντίσταση στον ιό όσο και η αποτελεσματικότητα ενός εμβολίου, θα συνδέονται με τη μιτοχονδριακή υγεία του ατόμου. Επιπλέον, καθώς τα στοιχεία δείχνουν ότι πολλοί ιοί, που πιθανότατα περιλαμβάνουν τον SARs-CoV-2, ρυθμίζουν τη βιοενέργεια και το redox τόσο στο ανοσοποιητικό σύστημα όσο και σε άλλα κύτταρα που μολύνουν για να ενισχύσουν τη δική τους αναπαραγωγή, θα μπορούσαν ενδεχομένως να προκαλέσουν υπερβολικό στρες σε αυτά τα συστήματα εάν τα μιτοχόνδρια είναι ήδη υπο-βέλτιστα λειτουργικά. Αυτό υποδηλώνει ότι σε ασθενείς που εμφανίζουν σοβαρότερα συμπτώματα, η μιτοχονδριακή υποστήριξη θα μπορούσε να είναι μια στρατηγική, η οποία θα μπορούσε να έχει πολλές μορφές, τόσο άμεσες (π.χ., μιτοχονδριακά αντιοξειδωτικά) ή έμμεσες (αντιφλεγμονώδη, αναστολείς της ιικής αντιγραφής κ.λπ.). Αυτή η άποψη γίνεται εμφανής όταν κάποιος θεωρεί ότι τα μιτοχόνδρια είναι ένας κεντρικός άξονας και έχουν πολλές λειτουργίες, που κυμαίνονται από την παροχή ενέργειας, τους αναβολίτες για τη νέα ανάπτυξη, τον έλεγχο της ενδοκυτταρικής οξειδοαναγωγής, τη σηματοδότηση ασβεστίου, την ανίχνευση ιών και την ενεργοποίηση αντι-ιικών μηχανισμών, καθώς και τελικά τον έλεγχο της ζωής και του θανάτου του κυττάρου. που κυμαίνονται από την παροχή ενέργειας, τους αναβολίτες για νέα ανάπτυξη, τον έλεγχο της ενδοκυτταρικής οξειδοαναγωγής, τη σηματοδότηση ασβεστίου, την ανίχνευση ιών και την ενεργοποίηση αντι-ιικών μηχανισμών, καθώς και τελικά τον έλεγχο της ζωής και του θανάτου του κυττάρου που κυμαίνονται από την παροχή ενέργειας, αναβολίτες για νέα ανάπτυξη, έλεγχο ενδοκυτταρικού redox, σηματοδότηση ασβεστίου, ανίχνευση ιών και ενεργοποίηση αντι-ιικών μηχανισμών, καθώς και τελικά έλεγχο της ζωής και του θανάτου του κυττάρου.
ΒΙΒΛΙΟΓΡΑΦΙΑ
- Clark A, Jit M, Warren-Gash C, Guthrie B, Wang HHX, Mercer SW, et al.Global, regional, and national estimates of the population at increased riskof severe COVID-19 due to underlying health conditions in 2020: amodelling study. Lancet Glob Health. 2020;8(8):e1003–e1017.
- Panigrahy D, Gilligan MM, Huang S, Gartung A, Cortes-Puch I, Sime PJ, et al.Inflammation resolution: a dual-pronged approach to averting cytokinestorms in COVID-19? Cancer Metastasis Rev. 2020;39(2):337–40.
- Chen J, Kelley WJ, Goldstein DR. Role of Aging and the Immune Responseto Respiratory Viral Infections: Potential Implications for COVID-19. JImmunol. 2020;205(2):313–20.
- Salminen A, Ojala J, Kaarniranta K, Kauppinen A. Mitochondrial dysfunctionand oxidative stress activate inflammasomes: impact on the aging processand age-related diseases. Cell MolLife Sci. 2012;69(18):2999–3013.
- Lane N. A unifying view of ageing and disease: the double-agent theory.JTheorBiol. 2003;225(4):531–40.
- Cunha LL, Perazzio SF, Azzi J, Cravedi P, Riella LV. Remodeling of theImmune Response With Aging: Immunosenescence and Its Potential Impacton COVID-19 Immune Response. Front Immunol. 2020;11(1748).
- Thomas R, Wang W, Su DM. Contributions of Age-Related Thymic Involutionto Immunosenescence and Inflammaging. Immun Ageing. 2020;17:2.
- Hamer M, Kivimaki M, Gale CR, Batty GD. Lifestyle Risk Factors forCardiovascular Disease in Relation to COVID-19 Hospitalization: ACommunity-Based Cohort Study of 387,109 Adults in UK. MedRxiv. 2020.
- Petrilli CM, Jones SA, Yang J, Rajagopalan H, O’Donnell LF, Chernyak Y, et al.Factors associated with hospitalization and critical illness among 4,103patients with COVID-19 disease in New York City. MedRxiv. 2020.
- Stefan N, Birkenfeld AL, Schulze MB, Ludwig DS. Obesity and impairedmetabolic health in patients with COVID-19. Nat Rev Endocrinol. 2020;16(7):341–2.
- Wang M, Baker JS, Quan W, Shen S, Fekete G, Gu Y. A Preventive Role ofExercise Across the Coronavirus 2 (SARS-CoV-2) Pandemic. Frontiers inPhysiology. 2020;11(1139).
- Nunn AV, Bell JD, Guy GW. Lifestyle-induced metabolic inflexibility andaccelerated ageing syndrome: insulin resistance, friend or foe? NutrMetab(Lond). 2009;6:16.
- van der Zalm IJB, van der Valk ES, Wester VL, Nagtzaam NMA, van Rossum EFC,Leenen PJM, et al. Obesity-associated T-cell and macrophage activation improvepartly after a lifestyle intervention. Int J Obes (Lond). 2020;44(9):1838–50.
- Petersen AM, Pedersen BK. The anti-inflammatory effect of exercise. J ApplPhysiol. 2005;98(4):1154–62.
- Brandt C, Pedersen BK. The role of exercise-induced myokines in musclehomeostasis and the defense against chronic diseases. J Biomed Biotechnol.2010;2010:520258.
- Sallam N, Laher I. Exercise Modulates Oxidative Stress and Inflammation inAging and Cardiovascular Diseases. Oxid Med Cell Longev. 2016;2016:7239639.
- Laurens C, Bergouignan A, Moro C. Exercise-Released Myokines in theControl of Energy Metabolism. Front Physiol. 2020;11:91.
- Chen K, Xu Z, Liu Y, Wang Z, Li Y, Xu X, et al. Irisin protects mitochondriafunction during pulmonary ischemia/reperfusion injury. Sci Transl Med.2017;9(418).
- de Oliveira M, De Sibio MT, Mathias LS, Rodrigues BM, Sakalem ME,Nogueira CR. Irisin modulates genes associated with severe coronavirusdisease (COVID-19) outcome in human subcutaneous adipocytes cellculture. Mol Cell Endocrinol. 2020;515:110917.
- Korta P, Pochec E, Mazur-Bialy A. Irisin as a Multifunctional Protein:Implications for Health and Certain Diseases. Medicina (Kaunas). 2019;55(8).
- Liepinsh E, Makarova E, Plakane L, Konrade I, Liepins K, Videja M, et al. Low-intensity exercise stimulates bioenergetics and increases fat oxidation inmitochondria of blood mononuclear cells from sedentary adults. PhysiolRep. 2020;8(12):e14489.
- Monlun M, Hyernard C, Blanco P, Lartigue L, Faustin B. Mitochondria asMolecular Platforms Integrating Multiple Innate Immune Signalings. J MolBiol. 2017;429(1):1–13.
- Tiku V, Tan MW, Dikic I. Mitochondrial Functions in Infection and Immunity.Trends Cell Biol. 2020;30(4):263–75.
- Kruk SK, Pacheco SE, Koenig MK, Bergerson JRE, Gordon-Lipkin E, McGuirePJ. Vulnerability of pediatric patients with mitochondrial disease to vaccine-preventable diseases. J Allergy Clin Immunol Pract. 2019;7(7):2415–2418 e3.
- Kapnick SM, Pacheco SE, McGuire PJ. The emerging role of immunedysfunction in mitochondrial diseases as a paradigm for understandingimmunometabolism. Metabolism. 2018;81:97–112.
- Thakar J, Mohanty S, West AP, Joshi SR, Ueda I, Wilson J, et al. Aging-dependent alterations in gene expression and a mitochondrial signature ofresponsiveness to human influenza vaccination. Aging (Albany NY). 2015;7(1):38–52.
- Gustine JN, Jones D. Immunopathology of Hyperinflammation in COVID-19.Am J Pathol. 2020.https://doi.org/10.1016/j.ajpath.2020.08.009.
- Wainberg MA, Mills EL. Mechanisms of virus-induced immune suppression.Can Med Assoc J. 1985;132(11):1261–7.
- Zinkernagel RM, Hengartner H. Virally induced immunosuppression. CurrOpin Immunol. 1992;4(4):408–12.
- Cheng MH, Zhang S, Porritt RA, Noval Rivas M, Paschold L, Willscher E, et al.Superantigenic character of an insert unique to SARS-CoV-2 spike supportedby skewed TCR repertoire in patients with hyperinflammation. Proc NatlAcad Sci U S A. 2020;17(41):25254–62.
- Jiang S. Mitochondrial oxidative phosphorylation is linked to T-cellexhaustion. Aging (Albany NY). 2020;12(17):16665–6.
- Thompson E, Cascino K, Ordonez A, Zhou W, Vaghasia A, Hamacher-BradyA, et al. Mitochondrial induced T cell apoptosis and aberrant myeloidmetabolic programs define distinct immune cell subsets during acute andrecovered SARS-CoV-2 infection. MedRxiv. 2020.
- Radzikowska U, Ding M, Tan G, Zhakparov D, Peng Y, Wawrzyniak P, et al.Distribution of ACE2, CD147, CD26, and other SARS-CoV-2 associatedmolecules in tissues and immune cells in health and in asthma, COPD,obesity, hypertension, and COVID-19 risk factors. Allergy. 2020.https://doi.org/10.1111/all.14429.
- Cantuti-Castelvetri L, Ojha R, Pedro LD, Djannatian M, Franz J, Kuivanen S,et al. Neuropilin-1 facilitates SARS-CoV-2 cell entry and provides a possiblepathway into the central nervous system. BioRxiv. 2020:2020.06.07.137802.
- Daly JL, Simonetti B, Antón-Plágaro C, Kavanagh Williamson M, ShoemarkDK, Simón-Gracia L, et al. Neuropilin-1 is a host factor for SARS-CoV-2infection. BioRxiv. 2020:2020.06.05.134114.
- Zhang X, Hubal MJ, Kraus VB. Immune cell extracellular vesicles and theirmitochondrial content decline with ageing. Immun Ageing. 2020;17:1.
- Desdin-Mico G, Soto-Heredero G, Aranda JF, Oller J, Carrasco E,Gabande-Rodriguez E, et al. T cells with dysfunctional mitochondriainduce multimorbidity and premature senescence. Science. 2020;368(6497):1371–6.
- Moderbacher CR, Ramirez SI, Dan JM, Grifoni A, Hastie KM, Weiskopf D, et al.Antigen-specific adaptive immunity to SARS-CoV-2 in acute COVID-19 andassociations with age and disease severity. Cell. 2020.https://doi.org/10.1016/j.cell.2020.09.038.
- Sekine T, Perez-Potti A, Rivera-Ballesteros O, Strålin K, Gorin J-B, Olsson A,et al. Robust T Cell Immunity in Convalescent Individuals withAsymptomatic or Mild COVID-19. Cell. 2020;183(1):158–68 e14.
- McGuire PJ. Mitochondrial Dysfunction and the Aging Immune System.Biology (Basel). 2019;8(2).
- Conte M, Martucci M, Chiariello A, Franceschi C, Salvioli S. Mitochondria,immunosenescence and inflammaging: a role for mitokines? SeminImmunopathol. 2020.
- Picca A, Lezza AMS, Leeuwenburgh C, Pesce V, Calvani R, Landi F, et al.Fueling Inflamm-Aging through Mitochondrial Dysfunction: Mechanismsand Molecular Targets. Int J Mol Sci. 2017;18(5).
- Callender LA, Carroll EC, Bober EA, Akbar AN, Solito E, Henson SM.Mitochondrial mass governs the extent of human T cell senescence. AgingCell. 2020;19(2):e13067.
- Gabande-Rodriguez E, Gomez de Las Heras MM, Mittelbrunn M. Control ofInflammation by Calorie Restriction Mimetics: On the Crossroad ofAutophagy and Mitochondria. Cells. 2019;9(1).
- Hannan MA, Rahman MA, Rahman MS, Sohag AAM, Dash R, Hossain KS,et al. Intermittent fasting, a possible priming tool for host defense againstSARS-CoV-2 infection: Crosstalk among calorie restriction, autophagy andimmune response. Immunol Lett. 2020;226:38–45.
- Livshits G, Kalinkovich A. Inflammaging as a common ground for thedevelopment and maintenance of sarcopenia, obesity, cardiomyopathy anddysbiosis. Ageing Res Rev. 2019;56:100980.
- Yu L, Chen X, Wang L, Chen S. Oncogenic virus-induced aerobic glycolysisand tumorigenesis. J Cancer. 2018;9(20):3699–706.
- Abdel-Haleem AM, Lewis NE, Jamshidi N, Mineta K, Gao X, Gojobori T. TheEmerging Facets of Non-Cancerous Warburg Effect. Front Endocrinol(Lausanne). 2017;8:279.
- Klarquist J, Chitrakar A, Pennock ND, Kilgore AM, Blain T, Zheng C, et al.Clonal expansion of vaccine-elicited T cells is independent of aerobicglycolysis. Sci Immunol. 2018;3(27).
- Zou X, Chen K, Zou J, Han P, Hao J, Han Z. Single-cell RNA-seq data analysison the receptor ACE2 expression reveals the potential risk of differenthuman organs vulnerable to 2019-nCoV infection. Front Med. 2020;14(2):185–92.
- Chen M, Shen W, Rowan NR, Kulaga H, Hillel A, Ramanathan M, Jr., et al.Elevated ACE2 expression in the olfactory neuroepithelium: implications foranosmia and upper respiratory SARS-CoV-2 entry and replication. BioRxiv. 2020.
- Lukassen S, Chua RL, Trefzer T, Kahn NC, Schneider MA, Muley T, et al. SARS-CoV-2 receptor ACE2 and TMPRSS2 are primarily expressed in bronchialtransient secretory cells. EMBO J. 2020;39(10):e105114.
- Al-Benna S. Association of high level gene expression of ACE2 in adiposetissue with mortality of COVID-19 infection in obese patients. Obes Med.2020;19:100283.
- Heialy SA, Hachim M, Senok A, Tayoun AA, Hamoudi R, Alsheikh-Ali A, et al.Regulation of angiotensin converting enzyme 2 (ACE2) in obesity:implications for COVID-19. BioRxiv. 2020:2020.04.17.046938.
- Liu C, von Brunn A, Zhu D. Cyclophilin A and CD147: novel therapeutictargets for the treatment of COVID-19. Med Drug Discov. 2020;7:100056.
- Sehirli AO, Sayiner S, Serakinci N. Role of melatonin in the treatment ofCOVID-19; as an adjuvant through cluster differentiation 147 (CD147). MolBiol Rep. 2020.https://doi.org/10.1007/s11033-020-05830-8.
- Helal MA, Shouman S, Abdelwaly A, Elmehrath AO, Essawy M, Sayed SM,et al. Molecular basis of the potential interaction of SARS-CoV-2 spikeprotein to CD147 in COVID-19 associated-lymphopenia. J Biomol Struct Dyn.2020:1–11.
- Perez-Miller S, Patek M, Moutal A, Cabel CR, Thorne CA, Campos SK, et al. Insilico identification and validation of inhibitors of the interaction betweenneuropilin receptor 1 and SARS-CoV-2 Spike protein. BioRxiv. 2020.
- Moutal A, Martin LF, Boinon L, Gomez K, Ran D, Zhou Y, et al. SARS-CoV-2Spike protein co-opts VEGF-A/Neuropilin-1 receptor signaling to induceanalgesia. Pain. 2020.https://doi.org/10.1097/j.pain.0000000000002097.
- Leclerc M, Voilin E, Gros G, Corgnac S, de Montpréville V, Validire P, et al.Regulation of antitumour CD8 T-cell immunity and checkpoint blockadeimmunotherapy by Neuropilin-1. Nature Communications. 2019;10(1):3345.
- Wang Y, Cao Y, Yamada S, Thirunavukkarasu M, Nin V, Joshi M, et al.Cardiomyopathy and Worsened Ischemic Heart Failure in SM22-alpha Cre-Mediated Neuropilin-1 Null Mice: Dysregulation of PGC1alpha andMitochondrial Homeostasis. Arterioscler Thromb Vasc Biol. 2015;35(6):1401–12.
- Shi CS, Qi HY, Boularan C, Huang NN, Abu-Asab M, Shelhamer JH, et al.SARS-coronavirus open reading frame-9b suppresses innate immunity bytargeting mitochondria and the MAVS/TRAF3/TRAF6 signalosome. JImmunol. 2014;193(6):3080–9.
- Hwang MS, Boulanger J, Howe JD, Albecka A, Pasche M, Muresan L, et al.MAVS polymers smaller than 80 nm induce mitochondrial membraneremodeling and interferon signaling. FEBS J. 2019;286(8):1543–60.
- Hou F, Sun L, Zheng H, Skaug B, Jiang QX, Chen ZJ. MAVS forms functionalprion-like aggregates to activate and propagate antiviral innate immuneresponse. Cell. 2011;146(3):448–61.
- Subramanian N, Natarajan K, Clatworthy MR, Wang Z, Germain RN. Theadaptor MAVS promotes NLRP3 mitochondrial localization andinflammasome activation. Cell. 2013;153(2):348–61.
- Gordon DE, Jang GM, Bouhaddou M, Xu J, Obernier K, White KM, et al. ASARS-CoV-2 protein interaction map reveals targets for drug repurposing.Nature. 2020;583(7816):459–68.
- Singh KK, Chaubey G, Chen JY, Suravajhala P. Decoding SARS-CoV-2Hijacking of Host Mitochondria in Pathogenesis of COVID-19. Am J PhysiolCell Physiol. 2020;319(2):C258–C267.
- Hyser JM, Estes MK. Pathophysiological Consequences of Calcium-Conducting Viroporins. Annu Rev Virol. 2015;2(1):473–96.
- Castano-Rodriguez C, Honrubia JM, Gutierrez-Alvarez J, DeDiego ML, Nieto-Torres JL, Jimenez-Guardeno JM, et al. Role of Severe Acute RespiratorySyndrome Coronavirus Viroporins E, 3a, and 8a in Replication andPathogenesis. MBio. 2018;9(3).
- Nieto-Torres JL, Verdia-Baguena C, Jimenez-Guardeno JM, Regla-Nava JA,Castano-Rodriguez C, Fernandez-Delgado R, et al. Severe acute respiratorysyndrome coronavirus E protein transports calcium ions and activates theNLRP3 inflammasome. Virology. 2015;485:330–9.
- Satarker S, Nampoothiri M. Structural Proteins in Severe Acute RespiratorySyndrome Coronavirus-2. Arch Med Res. 2020;51(6):482–91.
- Bravo-Sagua R, Parra V, Lopez-Crisosto C, Diaz P, Quest AF, Lavandero S.Calcium Transport and Signaling in Mitochondria. Compr Physiol. 2017;7(2):623–34.
- de Castro IF, Volonte L, Risco C. Virus factories: biogenesis and structuraldesign. Cell Microbiol. 2013;15(1):24–34.
- Novoa RR, Calderita G, Arranz R, Fontana J, Granzow H, Risco C. Virusfactories: associations of cell organelles for viral replication andmorphogenesis. Biol Cell. 2005;97(2):147–72.
- Sekine T, Perez-Potti A, Rivera-Ballesteros O, Strålin K, Gorin J-B, Olsson A,et al. Robust T cell immunity in convalescent individuals with asymptomaticor mild COVID-19. BioRxiv. 2020:2020.06.29.174888.
- Staines HM, Kirwan DE, Clark DJ, Adams ER, Augustin Y, Byrne RL, et al.Dynamics of IgG seroconversion and pathophysiology of COVID-19infections. MedRxiv. 2020:2020.06.07.20124636.
- Hadjadj J, Yatim N, Barnabei L, Corneau A, Boussier J, Smith N, et al.Impaired type I interferon activity and inflammatory responses in severeCOVID-19 patients. Science. 2020.
- Blanco-Melo D, Nilsson-Payant BE, Liu WC, Uhl S, Hoagland D, Moller R,et al. Imbalanced Host Response to SARS-CoV-2 Drives Development ofCOVID-19. Cell. 2020;181(5):1036–1045 e9.
- Dorward DA, Russell CD, Um IH, Elshani M, Armstrong SD, Penrice-Randal R,et al. Tissue-specific tolerance in fatal Covid-19. MedRxiv. 2020:2020.07.02.20145003.
- Guarda G, Braun M, Staehli F, Tardivel A, Mattmann C, Forster I, et al. Type Iinterferon inhibits interleukin-1 production and inflammasome activation.Immunity. 2011;34(2):213–23.
- Ratajczak MZ, Kucia M. SARS-CoV-2 infection and overactivation of Nlrp3inflammasome as a trigger of cytokine “storm” and risk factor for damage ofhematopoietic stem cells. Leukemia. 2020;34(7):1726–9.
- Huber JP, Farrar JD. Regulation of effector and memory T-cell functions bytype I interferon. Immunology. 2011;132(4):466–74.
- Ratajczak MZ, Bujko K, Ciechanowicz A, Sielatycka K, Cymer M, MarliczW, et al. SARS-CoV-2 Entry Receptor ACE2 Is Expressed on Very SmallCD45(−) Precursors of Hematopoietic and Endothelial Cells and inResponse to Virus Spike Protein Activates the Nlrp3 Inflammasome.Stem Cell Rev Rep. 2020.
- Santos RAS, Sampaio WO, Alzamora AC, Motta-Santos D, Alenina N, BaderM, et al. The ACE2/Angiotensin-(1–7)/MAS Axis of the Renin-AngiotensinSystem: Focus on Angiotensin-(1–7). Physiol Rev. 2018;98(1):505–53.
- Abadir PM, Foster DB, Crow M, Cooke CA, Rucker JJ, Jain A, et al.Identification and characterization of a functional mitochondrial angiotensinsystem. Proc Natl Acad Sci U S A. 2011;108(36):14849–54.
- Wang J, Chen S, Bihl J. Exosome-Mediated Transfer of ACE2 (Angiotensin-Converting Enzyme 2) from Endothelial Progenitor Cells Promotes Survivaland Function of Endothelial Cell. Oxid Med Cell Longev. 2020;2020:4213541.
- Sotomayor-Flores C, Rivera-Mejias P, Vasquez-Trincado C, Lopez-Crisosto C,Morales PE, Pennanen C, et al. Angiotensin-(1–9) prevents cardiomyocytehypertrophy by controlling mitochondrial dynamics via miR-129-3p/PKIApathway. Cell Death Differ. 2020;27(9):2586–604.
- Codo AC, Davanzo GG, Monteiro LdB, de Souza GF, Muraro SP, Virgilio-da-Silva JV, et al. Elevated Glucose Levels Favor SARS-CoV-2 Infection andMonocyte Response through a HIF-1α/Glycolysis-Dependent Axis. CellMetabolism. 2020.
- Finucane OM, Sugrue J, Rubio-Araiz A, Guillot-Sestier MV, Lynch MA. TheNLRP3 inflammasome modulates glycolysis by increasing PFKFB3 in an IL-1beta-dependent manner in macrophages. Sci Rep. 2019;9(1):4034.
- Hennig P, Garstkiewicz M, Grossi S, Di Filippo M, French LE, Beer HD. TheCrosstalk between Nrf2 and Inflammasomes. Int J Mol Sci. 2018;19(2).
- Brigelius-Flohe R, Flohe L. Basic Principles and Emerging Concepts inthe Redox Control of Transcription Factors. AntioxidRedoxSignal. 2011;15(8):2335–81.
- Reiter RJ, Sharma R, Ma Q, Dominquez-Rodriguez A, Marik PE, Abreu-Gonzalez P. Melatonin Inhibits COVID-19-induced Cytokine Storm byReversing Aerobic Glycolysis in Immune Cells: A Mechanistic Analysis. MedDrug Discov. 2020:100044.Nunnet al. Immunity & Ageing (2020) 17:33 Page 17 of 21
- Leon J, Acuna-Castroviejo D, Sainz RM, Mayo JC, Tan DX, Reiter RJ.Melatonin and mitochondrial function. Life Sci. 2004;75(7):765–90.
- Bouhaddou M, Memon D, Meyer B, White KM, Rezelj VV, Correa MarreroM, et al. The Global Phosphorylation Landscape of SARS-CoV-2Infection. Cell. 2020.
- Tutuncuoglu B, Cakir M, Batra J, Bouhaddou M, Eckhardt M, Gordon DE,et al. The Landscape of Human Cancer Proteins Targeted by SARS-CoV-2.Cancer Discov. 2020;10(7):916–21.
- Galli S, Jahn O, Hitt R, Hesse D, Opitz L, Plessmann U, et al. A new paradigmfor MAPK: structural interactions of hERK1 with mitochondria in HeLa cells.PLoS One. 2009;4(10):e7541.
- Cao M, Jiang J, Du Y, Yan P. Mitochondria-targeted antioxidant attenuateshigh glucose-induced P38 MAPK pathway activation in humanneuroblastoma cells. Mol Med Rep. 2012;5(4):929–34.
- Aluksanasuwan S, Plumworasawat S, Malaitad T, Chaiyarit S,Thongboonkerd V. High glucose induces phosphorylation and oxidationof mitochondrial proteins in renal tubular cells: A proteomics approach.Sci Rep. 2020;10(1):5843.
- Rubino F, Amiel SA, Zimmet P, Alberti G, Bornstein S, Eckel RH, et al. New-Onset Diabetes in Covid-19. N Engl J Med. 2020.
- Gupta R, Hussain A, Misra A. Diabetes and COVID-19: evidence, current statusand unanswered research questions. Eur J Clin Nutr. 2020;74(6):864–70.
- Mallapaty S. Mounting clues suggest the coronavirus might trigger diabetes.Nature. 2020;583(7814):16–7.
- Wang S, Ma P, Zhang S, Song S, Wang Z, Ma Y, et al. Fasting blood glucoseat admission is an independent predictor for 28-day mortality in patientswith COVID-19 without previous diagnosis of diabetes: a multi-centreretrospective study. Diabetologia. 2020.
- Vial G, Detaille D, Guigas B. Role of Mitochondria in the Mechanism(s) ofAction of Metformin. Front Endocrinol (Lausanne). 2019;10:294.
- Luo P, Qiu L, Liu Y, Liu XL, Zheng JL, Xue HY, et al. Metformin TreatmentWas Associated with Decreased Mortality in COVID-19 Patients withDiabetes in a Retrospective Analysis. Am J Trop Med Hyg. 2020.
- Bramante C, Ingraham N, Murray T, Marmor S, Hoversten S, Gronski J, et al.Observational Study of Metformin and Risk of Mortality in PatientsHospitalized with Covid-19. MedRxiv. 2020:2020.06.19.20135095.
- Christ A, Gunther P, Lauterbach MAR, Duewell P, Biswas D, Pelka K, et al.Western Diet Triggers NLRP3-Dependent Innate Immune Reprogramming.Cell. 2018;172(1–2):162–175 e14.
- Xie JH, Li YY, Jin J. The essential functions of mitochondrial dynamics inimmune cells. Cell Mol Immunol. 2020;17(7):712–21.
- Tapia PC. Sublethal mitochondrial stress with an attendant stoichiometricaugmentation of reactive oxygen species may precipitate many of thebeneficial alterations in cellular physiology produced by caloric restriction,intermittent fasting, exercise and dietary phytonutrients:“Mitohormesis”forhealth and vitality. MedHypotheses. 2006;66(4):832–43.
- Desler C, Hansen TL, Frederiksen JB, Marcker ML, Singh KK, Juel RasmussenL. Is There a Link between Mitochondrial Reserve Respiratory Capacity andAging? J Aging Res. 2012;2012:192503.
- Brown JC, McClelland GB, Faure PA, Klaiman JM, Staples JF. Examining themechanisms responsible for lower ROS release rates in liver mitochondriafrom the long-lived house sparrow (Passer domesticus) and big brown bat(Eptesicus fuscus) compared to the short-lived mouse (Mus musculus). MechAgeing Dev. 2009;130(8):467–76.
- Dela Cruz CS, Kang MJ. Mitochondrial dysfunction and damage associatedmolecular patterns (DAMPs) in chronic inflammatory diseases.Mitochondrion. 2018;41:37–44.
- Andersen KG, Rambaut A, Lipkin WI, Holmes EC, Garry RF. The proximalorigin of SARS-CoV-2. Nat Med. 2020;26(4):450–2.
- Mandl JN, Schneider C, Schneider DS, Baker ML. Going to Bat(s) for Studiesof Disease Tolerance. Front Immunol. 2018;9:2112.
- Banerjee A, Baker ML, Kulcsar K, Misra V, Plowright R, Mossman K. NovelInsights Into Immune Systems of Bats. Front Immunol. 2020;11:26.
- Zhang G, Cowled C, Shi Z, Huang Z, Bishop-Lilly KA, Fang X, et al.Comparative analysis of bat genomes provides insight into the evolution offlight and immunity. Science. 2013;339(6118):456–60.
- Ahn M, Anderson DE, Zhang Q, Tan CW, Lim BL, Luko K, et al. DampenedNLRP3-mediated inflammation in bats and implications for a special viralreservoir host. Nat Microbiol. 2019;4(5):789–99.
- Hayman DTS. Bat tolerance to viral infections. Nat Microbiol. 2019;4(5):728–9.
- Yabal M, Calleja DJ, Simpson DS, Lawlor KE. Stressing out the mitochondria:Mechanistic insights into NLRP3 inflammasome activation. J Leukoc Biol.2019;105(2):377–99.
- Jebb D, Foley NM, Whelan CV, Touzalin F, Puechmaille SJ, Teeling EC.Population level mitogenomics of long-lived bats reveals dynamicheteroplasmy and challenges the Free Radical Theory of Ageing. Sci Rep.2018;8(1):13634.
- Kim MJ, Yoon JH, Ryu JH. Mitophagy: a balance regulator of NLRP3inflammasome activation. BMB Rep. 2016;49(10):529–35.
- Gassen NC, Papies J, Bajaj T, Dethloff F, Emanuel J, Weckmann K, et al.Analysis of SARS-CoV-2-controlled autophagy reveals spermidine, MK-2206,and niclosamide as putative antiviral therapeutics. BioRxiv. 2020.
- Xie LL, Shi F, Tan Z, Li Y, Bode AM, Cao Y. Mitochondrial network structurehomeostasis and cell death. Cancer Sci. 2018;109(12):3686–94.
- Lagerwaard B, Keijer J, McCully KK, de Boer VCJ, Nieuwenhuizen AG. In vivoassessment of muscle mitochondrial functioninhealthy,youngmalesinrelationto parameters of aerobic fitness. Eur J Appl Physiol. 2019;119(8):1799–808.
- Robinson MM, Dasari S, Konopka AR, Johnson ML, Manjunatha S, EspondaRR, et al. Enhanced Protein Translation Underlies Improved Metabolic andPhysical Adaptations to Different Exercise Training Modes in Young and OldHumans. Cell Metab. 2017;25(3):581–92.
- Gopinath B, Kifley A, Flood VM, Mitchell P. Physical Activity as a Determinantof Successful Aging over Ten Years. Sci Rep. 2018;8(1):10522.
- Goto S, Radak Z. Hormetic effects of reactive oxygen species by exercise: aview from animal studies for successful aging in human. DoseResponse.2009;8(1):68–72.
- Wu J, Weisshaar N, Hotz-Wagenblatt A, Madi A, Ma S, Mieg A, et al. Skeletalmuscle antagonizes antiviral CD8(+) T cell exhaustion. Sci Adv. 2020;6(24):eaba3458.
- Kaminski DA, Randall TD. Adaptive immunity and adipose tissue biology.Trends Immunol. 2010;31(10):384–90.
- Vissers D, Hens W, Taeymans J, Baeyens JP, Poortmans J, Van Gaal L. Theeffect of exercise on visceral adipose tissue in overweight adults: asystematic review and meta-analysis. PLoS One. 2013;8(2):e56415.
- Chan CC, Damen M, Moreno-Fernandez ME, Stankiewicz TE, Cappelletti M,Alarcon PC, et al. Type I interferon sensing unlocks dormant adipocyteinflammatory potential. Nat Commun. 2020;11(1):2745.
- Vandanmagsar B, Youm YH, Ravussin A, Galgani JE, Stadler K, Mynatt RL,et al. The NLRP3 inflammasome instigates obesity-induced inflammationand insulin resistance. Nat Med. 2011;17(2):179–88.
- Bar-Ziv R, Bolas T, Dillin A. Systemic effects of mitochondrial stress. EMBORep. 2020;21(6):e50094.
- Ristow M, Zarse K. How increased oxidative stress promotes longevity andmetabolic health: The concept of mitochondrial hormesis (mitohormesis).ExpGerontol. 2010;45(6):410–8.
- Burhans WC, Heintz NH. The cell cycle is a redox cycle: linking phase-specific targets to cell fate. Free Radic Biol Med. 2009;47(9):1282–93.
- Wojtovich AP, Berry BJ, Galkin A. Redox Signaling ThroughCompartmentalization of Reactive Oxygen Species: Implications for Healthand Disease. Antioxid Redox Signal. 2019;31(9):591–3.
- Jones DP. Redox theory of aging. Redox Biol. 2015;5:71–9.
- Banoth B, Cassel SL. Mitochondria in innate immune signaling. Transl Res.2018;202:52–68.
- Ohta A, Nishiyama Y. Mitochondria and viruses. Mitochondrion. 2011;11(1):1–12.
- Munro D, Baldy C, Pamenter ME, Treberg JR. The exceptional longevity ofthe naked mole-rat may be explained by mitochondrial antioxidantdefenses. Aging Cell. 2019;18(3):e12916.
- Kamunde C, Sharaf M, MacDonald N. H2O2 metabolism in liver and heartmitochondria: Low emitting-high scavenging and high emitting-lowscavenging systems. Free Radic Biol Med. 2018;124:135–48.
- Vyssokikh MY, Holtze S, Averina OA, Lyamzaev KG, Panteleeva AA, MareyMV, et al. Mild depolarization of the inner mitochondrial membrane is acrucial component of an anti-aging program. Proc Natl Acad Sci U S A.2020;117(12):6491–501.
- Aon MA, Cortassa S, O’Rourke B. Redox-optimized ROS balance: a unifyinghypothesis. Biochim Biophys Acta. 2010;1797(6–7):865–77.
- Cortassa S, O’Rourke B, Aon MA. Redox-optimized ROS balance and therelationship between mitochondrial respiration and ROS. Biochim BiophysActa. 2014;1837(2):287–95.
- Klaus S, Ost M. Mitochondrial uncoupling and longevity – A role formitokines? Exp Gerontol. 2020;130:110796.
- Du RH, Wu FF, Lu M, Shu XD, Ding JH, Wu G, et al. Uncoupling protein 2modulation of the NLRP3 inflammasome in astrocytes and its implicationsin depression. Redox Biol. 2016;9:178–87.
- Emre Y, Nubel T. Uncoupling protein UCP2: when mitochondrial activitymeets immunity. FEBS Lett. 2010;584(8):1437–42.
- Salin K, Villasevil EM, Anderson GJ, Selman C, Chinopoulos C, Metcalfe NB.The RCR and ATP/O Indices Can Give Contradictory Messages aboutMitochondrial Efficiency. Integr Comp Biol. 2018;58(3):486–94.
- Konopka AR, Asante A, Lanza IR, Robinson MM, Johnson ML, Dalla Man C,et al. Defects in mitochondrial efficiency and H2O2 emissions in obesewomen are restored to a lean phenotype with aerobic exercise training.Diabetes. 2015;64(6):2104–15.
- Jezek P, Holendova B, Garlid KD, Jaburek M. Mitochondrial UncouplingProteins: Subtle Regulators of Cellular Redox Signaling. Antioxid RedoxSignal. 2018;29(7):667–714.
- Ryoo IG, Kwak MK. Regulatory crosstalk between the oxidative stress-relatedtranscription factor Nfe2l2/Nrf2 and mitochondria. Toxicol Appl Pharmacol.2018;359:24–33.
- Chen T, Wu D, Chen H, Yan W, Yang D, Chen G, et al. Clinical characteristicsof 113 deceased patients with coronavirus disease 2019: retrospective study.BMJ. 2020;368:m1091.
- Jang JY, Blum A, Liu J, Finkel T. The role of mitochondria in aging. J ClinInvest. 2018;128(9):3662–70.
- Prasun P. Mitochondrial dysfunction in metabolic syndrome. BiochimBiophys Acta Mol Basis Dis. 1866;2020(10):165838.
- Han Y, Franzen J, Stiehl T, Gobs M, Kuo CC, Nikolic M, et al. New targetedapproaches for epigenetic age predictions. BMC Biol. 2020;18(1):71.
- Fransquet PD, Wrigglesworth J, Woods RL, Ernst ME, Ryan J. The epigeneticclock as a predictor of disease and mortality risk: a systematic review andmeta-analysis. Clin Epigenetics. 2019;11(1):62.
- Dolcini J, Wu H, Nwanaji-Enwerem JC, Kiomourtozlogu MA, Cayir A,Sanchez-Guerra M, et al. Mitochondria and aging in older individuals: ananalysis of DNA methylation age metrics, leukocyte telomere length, andmitochondrial DNA copy number in the VA normative aging study. Aging(Albany NY). 2020;12(3):2070–83.
- Atamna H, Tenore A, Lui F, Dhahbi JM. Organ reserve, excess metaboliccapacity, and aging. Biogerontology. 2018;19(2):171–84.
- Pillai PS, Molony RD, Martinod K, Dong H, Pang IK, Tal MC, et al. Mx1 revealsinnate pathways to antiviral resistance and lethal influenza disease. Science.2016;352(6284):463–6.
- Sgarbanti R, Amatore D, Celestino I, Marcocci ME, Fraternale A, Ciriolo MR,et al. Intracellular redox state as target for anti-influenza therapy: areantioxidants always effective? Curr Top Med Chem. 2014;14(22):2529–41.
- Amatore D, Celestino I, Brundu S, Galluzzi L, Coluccio P, Checconi P, et al.Glutathione increase by the n-butanoyl glutathione derivative (GSH-C4)inhibits viral replication and induces a predominant Th1 immune profile inold mice infected with influenza virus. FASEB Bioadv. 2019;1(5):296–305.
- Lopez-Otin C, Blasco MA, Partridge L, Serrano M, Kroemer G. The hallmarksof aging. Cell. 2013;153(6):1194–217.
- Lane N. The Vital Question: Why is Life the way it is? Great Britain: ProfileBooks Ltd; 2015.
- Constantin-Teodosiu D, Constantin D, Pelsers MM, Verdijk LB, van Loon L,Greenhaff PL. Mitochondrial DNA copy number associates with insulinsensitivity and aerobic capacity, and differs between sedentary, overweightmiddle-aged males with and without type 2 diabetes. Int J Obes (Lond).2020;44(4):929–36.
- Yuliya B, Roman G, Clifford G. W, Siarhei K. Highlights of COVID-19Pathogenesis. Insights into Oxidative Damage. 2020.
- Wong CM, Lai HK, Ou CQ, Ho SY, Chan KP, Thach TQ, et al. Is exerciseprotective against influenza-associated mortality? PLoS One. 2008;3(5):e2108.
- Mandsager K, Harb S, Cremer P, Phelan D, Nissen SE, Jaber W. Association ofCardiorespiratory Fitness With Long-term Mortality Among AdultsUndergoing Exercise Treadmill Testing. JAMA Netw Open. 2018;1(6):e183605.
- Ekelund U, Tarp J, Steene-Johannessen J, Hansen BH, Jefferis B, FagerlandMW, et al. Dose-response associations between accelerometry measuredphysical activity and sedentary time and all cause mortality: systematicreview and harmonised meta-analysis. BMJ. 2019;366:l4570.
- Cerqueira E, Marinho DA, Neiva HP, Lourenco O. Inflammatory Effects ofHigh and Moderate Intensity Exercise-A Systematic Review. Front Physiol.2019;10:1550.
- de Sousa CV, Sales MM, Rosa TS, Lewis JE, de Andrade RV, Simoes HG. TheAntioxidant Effect of Exercise: A Systematic Review and Meta-Analysis.Sports Med. 2017;47(2):277–93.
- Ma S, Sun S, Geng L, Song M, Wang W, Ye Y, et al. Caloric RestrictionReprograms the Single-Cell Transcriptional Landscape ofRattus norvegicusAging. Cell. 2020;180(5):984–1001 e22.
- Guarente L. Mitochondria–a nexus for aging, calorie restriction, and sirtuins?Cell. 2008;132(2):171–6.
- Calder PC, Bosco N, Bourdet-Sicard R, Capuron L, Delzenne N, Dore J, et al.Health relevance of the modification of low grade inflammation in ageing(inflammageing) and the role of nutrition. Ageing Res Rev. 2017;40:95–119.
- Liu Q, Zhou YH, Yang ZQ. The cytokine storm of severe influenza anddevelopment of immunomodulatory therapy. Cell Mol Immunol. 2016;13(1):3–10.
- Picard M, McEwen BS, Epel ES, Sandi C. An energetic view of stress: Focuson mitochondria. Front Neuroendocrinol. 2018;49:72–85.
- Wenz T. Mitochondria and PGC-1alpha in Aging and Age-AssociatedDiseases. J Aging Res. 2011;2011:810619.
- Sandoval-Acuna C, Lopez-Alarcon C, Aliaga ME, Speisky H. Inhibition ofmitochondrial complex I by various non-steroidal anti-inflammatory drugsand its protection by quercetin via a coenzyme Q-like action. Chem BiolInteract. 2012;199(1):18–28.
- Stein BD, Calzolari D, Hellberg K, Hu YS, He L, Hung CM, et al. QuantitativeIn Vivo Proteomics of Metformin Response in Liver Reveals AMPK-Dependent and -Independent Signaling Networks. Cell Rep. 2019;29(10):3331–3348 e7.
- Gorlach S, Fichna J, Lewandowska U. Polyphenols as mitochondria-targetedanticancer drugs. Cancer Lett. 2015;366(2):141–9.
- Tatematsu Y, Fujita H, Hayashi H, Yamamoto A, Tabata A, Nagamune H,et al. Effects of the Nonsteroidal Anti-inflammatory Drug Celecoxib onMitochondrial Function. Biol Pharm Bull. 2018;41(3):319–25.
- Zhou Y, Hou Y, Shen J, Huang Y, Martin W, Cheng F. Network-baseddrug repurposing for novel coronavirus 2019-nCoV/SARS-CoV-2. CellDiscov. 2020;6:14.
- Eirin A, Lerman A, Lerman LO. Enhancing Mitochondrial Health to TreatHypertension. Curr Hypertens Rep. 2018;20(10):89.
- Elmorsy E, Al-Ghafari A, Helaly ANM, Hisab AS, Oehrle B, Smith PA. Editor’sHighlight: Therapeutic Concentrations of Antidepressants Inhibit PancreaticBeta-Cell Function via Mitochondrial Complex Inhibition. Toxicol Sci. 2017;158(2):286–301.
- Wei Y, Zhang YJ, Cai Y, Xu MH. The role of mitochondria in mTOR-regulatedlongevity. Biol Rev Camb Philos Soc. 2015;90(1):167–81.
- Villa-Cuesta E, Holmbeck MA, Rand DM. Rapamycin increases mitochondrialefficiency by mtDNA-dependent reprogramming of mitochondrialmetabolism in Drosophila. J Cell Sci. 2014;127(Pt 10):2282–90.
- Vitte J, Michel M, Mezouar S, Diallo AB, Boumaza A, Mege JL, et al. ImmuneModulation as a Therapeutic Option During the SARS-CoV-2 Outbreak: TheCase for Antimalarial Aminoquinolines. Front Immunol. 2020;11:2159.
- Katewa SD, Katyare SS. Treatment with antimalarials adversely affects theoxidative energy metabolism in rat liver mitochondria. Drug Chem Toxicol.2004;27(1):41–53.
- Macedo TS, Villarreal W, Couto CC, Moreira DRM, Navarro M, Machado M,et al. Platinum (ii)-chloroquine complexes are antimalarial agents againstblood and liver stages by impairing mitochondrial function. Metallomics.2017;9(11):1548–61.
- Dhanabalan K, Huisamen B, Lochner A. Mitochondrial oxidativephosphorylation and mitophagy in myocardial ischaemia/reperfusion:effects of chloroquine. Cardiovasc J Afr. 2019;30:1–11.
- Miyachi Y, Yoshioka A, Imamura S, Niwa Y. Antioxidant action ofantimalarials. Ann Rheum Dis. 1986;45(3):244–8.
- Klouda CB, Stone WL. Oxidative Stress, Proton Fluxes, and Chloroquine/Hydroxychloroquine Treatment for COVID-19. Antioxidants (Basel). 2020;9(9).
- Hussain N, Chung E, Heyl JJ, Hussain B, Oh MC, Pinon C, et al. A Meta-Analysis on the Effects of Hydroxychloroquine on COVID-19. Cureus. 2020;12(8):e10005.
- Goldman A, Bomze D, Dankner R, Hod H, Meirson T, Boursi B, et al.Cardiovascular adverse events associated with hydroxychloroquine andchloroquine: A comprehensive pharmacovigilance analysis of pre-COVID-19reports. Br J Clin Pharmacol. 2020.https://doi.org/10.1111/bcp.14546.
- Lammers AJJ, Brohet RM, Theunissen REP, Koster C, Rood R, Verhagen DWM,et al. Early Hydroxychloroquine but not Chloroquine use reduces ICU admission in COVID-19 patients. Int J Infect Dis. 2020.https://doi.org/10.1016/j.ijid.2020.09.1460.
- Calabrese EJ, Hanekamp JC, Hanekamp YN, Kapoor R, Dhawan G,Agathokleous E. Chloroquine commonly induces hormetic dose responses.Sci Total Environ. 2020;755(1):142436.
- Deftereos SG, Siasos G, Giannopoulos G, Vrachatis DA, Angelidis C, GiotakiSG, et al. The Greek study in the effects of colchicine in COvid-19complications prevention (GRECCO-19 study): Rationale and study design.Hellenic J Cardiol. 2020;61(1):42–5.
- Buch BT, Halling JF, Ringholm S, Gudiksen A, Kjobsted R, Olsen MA, et al.Colchicine treatment impairs skeletal muscle mitochondrial function andinsulin sensitivity in an age-specific manner. FASEB J. 2020;34(6):8653–70.
- Wehbe Z, Hammoud S, Soudani N, Zaraket H, El-Yazbi A, Eid AH. MolecularInsights Into SARS COV-2 Interaction With Cardiovascular Disease: Role ofRAAS and MAPK Signaling. Front Pharmacol. 2020;11:836.
- Grimes JM, Grimes KV. p38 MAPK inhibition: A promising therapeuticapproach for COVID-19. J Mol Cell Cardiol. 2020;144:63–5.
- Ferraz LS, Costa RTD, Costa CAD, Ribeiro CAJ, Arruda DC, Maria-Engler SS,et al. Targeting mitochondria in melanoma: Interplay between MAPKsignaling pathway and mitochondrial dynamics. Biochem Pharmacol. 2020;178:114104.
- Poulsen NN, von Brunn A, Hornum M, Blomberg Jensen M. Cyclosporineand COVID-19: Risk or favorable? Am J Transplant. 2020.
- Sauerhering L, Kupke A, Meier L, Dietzel E, Hoppe J, Gruber AD, et al.Cyclophilin Inhibitors Restrict Middle East Respiratory Syndrome CoronavirusVia Interferon lambda In Vitro And In Mice. Eur Respir J. 2020.https://doi.org/10.1183/13993003.01826-2019.
- Ren Z, Ding T, Zuo Z, Xu Z, Deng J, Wei Z. Regulation of MAVS Expressionand Signaling Function in the Antiviral Innate Immune Response. FrontImmunol. 2020;11:1030.
- Akiyama T, Shiraishi T, Qin J, Konno H, Akiyama N, Shinzawa M, et al.Mitochondria-nucleus shuttling FK506-binding protein 51 interacts withTRAF proteins and facilitates the RIG-I-like receptor-mediated expression oftype I IFN. PLoS One. 2014;9(5):e95992.
- Liu W, Li J, Zheng W, Shang Y, Zhao Z, Wang S, et al. Cyclophilin A-regulated ubiquitination is critical for RIG-I-mediated antiviral immuneresponses. Elife. 2017:6.
- Amanakis G, Murphy E. Cyclophilin D: An Integrator of MitochondrialFunction. Front Physiol. 2020;11:595.
- Softic L, Brillet R, Berry F, Ahnou N, Nevers Q, Morin-Dewaele M, et al.Inhibition of SARS-CoV-2 Infection by the Cyclophilin Inhibitor Alisporivir(Debio 025). Antimicrob Agents Chemother. 2020;64(7).
- Mahase E. Covid-19: Low dose steroid cuts death in ventilated patients byone third, trial finds. BMJ. 2020;369:m2422.
- Syed AP, Greulich F, Ansari SA, Uhlenhaut NH. Anti-inflammatoryglucocorticoid action: genomic insights and emerging concepts. Curr OpinPharmacol. 2020;53:35–44.
- Lapp HE, Bartlett AA, Hunter RG. Stress and glucocorticoid receptorregulation of mitochondrial gene expression. J Mol Endocrinol. 2019;62(2):R121–R8.
- Arvier M, Lagoutte L, Johnson G, Dumas JF, Sion B, Grizard G, et al. Adeninenucleotide translocator promotes oxidative phosphorylation and milduncoupling in mitochondria after dexamethasone treatment. Am J PhysiolEndocrinol Metab. 2007;293(5):E1320–4.
- Luan G, Li G, Ma X, Jin Y, Hu N, Li J, et al. Dexamethasone-InducedMitochondrial Dysfunction and Insulin Resistance-Study in 3T3-L1Adipocytes and Mitochondria Isolated from Mouse Liver. Molecules.2019;24(10).
- Lei Y, Wang K, Deng L, Chen Y, Nice EC, Huang C. Redox regulation ofinflammation: old elements, a new story. Med Res Rev. 2015;35(2):306–40.
- Mandl J, Szarka A, Banhegyi G. Vitamin C: update on physiology andpharmacology. Br J Pharmacol. 2009;157(7):1097–110.
- Hemila H, Chalker E. Vitamin C may reduce the duration of mechanicalventilation in critically ill patients: a meta-regression analysis. J IntensiveCare. 2020;8:15.
- Hemila H, Chalker E. Vitamin C Can Shorten the Length of Stay in the ICU: AMeta-Analysis. Nutrients. 2019;11(4).
- Colunga Biancatelli RML, Berrill M, Catravas JD, Marik PE. Quercetin andVitamin C: An Experimental, Synergistic Therapy for the Prevention andTreatment of SARS-CoV-2 Related Disease (COVID-19). Frontiers inImmunology. 2020;11(1451).
- Fiorani M, Guidarelli A, Blasa M, Azzolini C, Candiracci M, Piatti E, et al.Mitochondria accumulate large amounts of quercetin: prevention ofmitochondrial damage and release upon oxidation of the extramitochondrialfraction of the flavonoid. JNutrBiochem. 2010;21(5):397–404.
- Rayamajhi N, Kim SK, Go H, Joe Y, Callaway Z, Kang JG, et al. Quercetininduces mitochondrial biogenesis through activation of HO-1 in HepG2cells. Oxid Med Cell Longev. 2013;2013:154279.
- Nunn AVW, Guy GW, Botchway SW, Bell JD. From sunscreens to medicines:Can a dissipation hypothesis explain the beneficial aspects of many plantcompounds? Phytother Res. 2020;34(8):1868–88.
- Zhou JM, Zhang Y. Plant Immunity: Danger Perception and Signaling. Cell.2020;181(5):978–89.
- Nie S, Yue H, Zhou J, Xing D. Mitochondrial-derived reactive oxygen speciesplay a vital role in the salicylic acid signaling pathway inArabidopsisthaliana. PLoS One. 2015;10(3):e0119853.
- Norman C, Howell KA, Millar AH, Whelan JM, Day DA. Salicylic acid is anuncoupler and inhibitor of mitochondrial electron transport. Plant Physiol.2004;134(1):492–501.
- Liu Z, Luo QH, Wen GQ, Wang JM, Li XF, Yang Y. VDAC2 involvement in thestress response pathway inArabidopsis thaliana. Genet Mol Res. 2015;14(4):15511–9.
- Zvereva AS, Golyaev V, Turco S, Gubaeva EG, Rajeswaran R, SchepetilnikovMV, et al. Viral protein suppresses oxidative burst and salicylic acid-dependent autophagy and facilitates bacterial growth on virus-infectedplants. New Phytol. 2016;211(3):1020–34.
- Gurbel PA, Bliden KP, Schror K. Can an Old Ally Defeat a New Enemy?Circulation. 2020;142(4):315–7.
- Hill PA. Cannabinoids and the coronavirus. Cann Cann Res. 2020;5(2):118–20.
- Ibeas Bih C, Chen T, Nunn AV, Bazelot M, Dallas M, Whalley BJ. MolecularTargets of Cannabidiol in Neurological Disorders. Neurotherapeutics. 2015;12(4):699–730.
- Rimmerman N, Ben-Hail D, Porat Z, Juknat A, Kozela E, Daniels MP, et al.Direct modulation of the outer mitochondrial membrane channel, voltage-dependent anion channel 1 (VDAC1) by cannabidiol: a novel mechanismfor cannabinoid-induced cell death. Cell Death Dis. 2013;4:e949.
- Fisar Z, Singh N, Hroudova J. Cannabinoid-induced changes in respiration ofbrain mitochondria. Toxicol Lett. 2014;231(1):62–71.
- Libro R, Scionti D, Diomede F, Marchisio M, Grassi G, Pollastro F, et al.Cannabidiol Modulates the Immunophenotype and Inhibits the Activationof the Inflammasome in Human Gingival Mesenchymal Stem Cells. FrontPhysiol. 2016;7:559.
- Calabrese V, Cornelius C. nkova-Kostova AT, Iavicoli I, Di PR, Koverech A,et al. Cellular stress responses, hormetic phytochemicals and vitagenes inaging and longevity. BiochimBiophysActa. 2012;1822(5):753–83.
- Nadanaciva S, Dykens JA, Bernal A, Capaldi RA, Will Y. Mitochondrialimpairment by PPAR agonists and statins identified via immunocapturedOXPHOS complex activities and respiration. ToxicolApplPharmacol. 2007;223(3):277–87.
- Christie CF, Fang D, Hunt EG, Morris ME, Rovini A, Heslop KA, et al. Statin-dependent modulation of mitochondrial metabolism in cancer cells isindependent of cholesterol content. FASEB J. 2019;33(7):8186–201.
- Dohlmann TL, Morville T, Kuhlman AB, Chrois KM, Helge JW, Dela F, et al.Statin Treatment Decreases Mitochondrial Respiration But Muscle CoenzymeQ10 Levels Are Unaltered: The LIFESTAT Study. J Clin Endocrinol Metab.2019;104(7):2501–8.
- Zhang X-J, Qin J-J, Cheng X, Shen L, Zhao Y-C, Yuan Y, et al. In-Hospital Useof Statins Is Associated with a Reduced Risk of Mortality among Individualswith COVID-19. Cell Metabolism. 2020;32(2):176–87 e4.
- Cardinali DP, Pagano ES, Scacchi Bernasconi PA, Reynoso R, Scacchi P.Melatonin and mitochondrial dysfunction in the central nervous system.Horm Behav. 2013;63(2):322–30.
- Zhang R, Wang X, Ni L, Di X, Ma B, Niu S, et al. COVID-19: Melatonin as apotential adjuvant treatment. Life Sci. 2020:117583.
- Yao X, Carlson D, Sun Y, Ma L, Wolf SE, Minei JP, et al. Mitochondrial ROSInduces Cardiac Inflammation via a Pathway through mtDNA Damage in aPneumonia-Related Sepsis Model. PLoS One. 2015;10(10):e0139416.
- Riley JS, Tait SW. Mitochondrial DNA in inflammation and immunity. EMBORep. 2020;21(4):e49799.
- Grant WB, Lahore H, McDonnell SL, Baggerly CA, French CB, Aliano JL, et al.Evidence that Vitamin D Supplementation Could Reduce Risk of Influenzaand COVID-19 Infections and Deaths. Nutrients. 2020;12(4).
- Ryan ZC, Craig TA, Folmes CD, Wang X, Lanza IR, Schaible NS, et al.1alpha,25-Dihydroxyvitamin D3 Regulates Mitochondrial OxygenConsumption and Dynamics in Human Skeletal Muscle Cells. J Biol Chem.2016;291(3):1514–28.
- Silvagno F, Pescarmona G. Spotlight on vitamin D receptor, lipidmetabolism and mitochondria: Some preliminary emerging issues. Mol CellEndocrinol. 2017;450:24–31.
- Rhodes JM, Subramanian S, Laird E, Griffin G, Kenny RA. Perspective: VitaminD deficiency and COVID-19 severity – plausibly linked by latitude, ethnicity,impacts on cytokines, ACE2, and thrombosis (R1). J Intern Med. 2020.https://doi.org/10.1111/joim.13149.
- Khan NA, Auranen M, Paetau I, Pirinen E, Euro L, Forsstrom S, et al. Effectivetreatment of mitochondrial myopathy by nicotinamide riboside, a vitaminB3. EMBO Mol Med. 2014;6(6):721–31.
- Shi Y, Wang Y, Shao C, Huang J, Gan J, Huang X, et al. COVID-19 infection:the perspectives on immune responses. Cell Death Differ. 2020;27(5):1451–4.
- Zinovkin RA, Zamyatnin AA. Mitochondria-Targeted Drugs. Curr MolPharmacol. 2019;12(3):202–14.
- Reddy PV, Lungu G, Kuang X, Stoica G, Wong PK. Neuroprotective effects ofthe drug GVT (monosodium luminol) are mediated by the stabilization ofNrf2 in astrocytes. Neurochem Int. 2010;56(6–7):780–8.
- Shetty AK, Attaluri S, Kodali M, Shuai B, Shetty GA, Upadhya D, et al.Monosodium luminol reinstates redox homeostasis, improves cognition,mood and neurogenesis, and alleviates neuro- and systemic inflammationin a model of Gulf War Illness. Redox Biol. 2020;28:101389.
- Brysch W, Schumann S, Schulz P, Shah M, Mangano K, Fagone P, et al. P-173- MP1032 – a novel anti-inflammatory drug ameliorates the progression ofautoimmune diseases. Free Radic Biol Med. 2018;120(1):S96–S7.
- Li Y, Zhu H, Trush MA. Detection of mitochondria-derived reactive oxygenspecies production by the chemilumigenic probes lucigenin and luminol.Biochim Biophys Acta. 1999;1428(1):1–12.
- Reber AJ, Chirkova T, Kim JH, Cao W, Biber R, Shay DK, et al.Immunosenescence and Challenges of Vaccination against Influenza in theAging Population. Aging Dis. 2012;3(1):68–90.
- Ongradi J, Kovesdi V. Factors that may impact on immunosenescence: anappraisal. Immun Ageing. 2010;7:7.
- Frasca D, Blomberg BB. The Impact of Obesity and Metabolic Syndrome onVaccination Success. Interdiscip Top Gerontol Geriatr. 2020;43:86–97.
- Kennedy RB, Ovsyannikova IG, Haralambieva IH, Oberg AL, ZimmermannMT, Grill DE, et al. Immunosenescence-Related Transcriptomic andImmunologic Changes in Older Individuals Following Influenza Vaccination.Front Immunol. 2016;7:450.
- Kutschera U. Gender-specific coronavirus-infections in the light of evolution.Science. 2020;367(6483).
- Jin J-M, Bai P, He W, Wu F, Liu X-F, Han D-M, et al. Gender differences inpatients with COVID-19: Focus on severity and mortality. MedRxiv. 2020:2020.02.23.20026864.
- Ventura-Clapier R, Moulin M, Piquereau J, Lemaire C, Mericskay M, Veksler V,et al. Mitochondria: a central target for sex differences in pathologies. ClinSci (Lond). 2017;131(9):803–22.
- Jiang Y, Niu Y, Xia Y, Liu C, Lin Z, Wang W, et al. Effects of personal nitrogendioxide exposure on airway inflammation and lung function. Environ Res.2019;177:108620.
- Silkstone RS, Mason MG, Nicholls P, Cooper CE. Nitrogen dioxide oxidizesmitochondrial cytochrome c. Free Radic Biol Med. 2012;52(1):80–7.
- Yan W, Ji X, Shi J, Li G, Sang N. Acute nitrogen dioxide inhalation inducesmitochondrial dysfunction in rat brain. Environ Res. 2015;138:416–24.
- Travaglio M, Yu Y, Popovic R, Leal NS, Martins LM. Links between airpollution and COVID-19 in England. MedRxiv. 2020.
- Maher BA, Gonzalez-Maciel A, Reynoso-Robles R, Torres-Jardon R, Calderon-Garciduenas L. Iron-rich air pollution nanoparticles: An unrecognisedenvironmental risk factor for myocardial mitochondrial dysfunction andcardiac oxidative stress. Environ Res. 2020;188:109816.
- Song W, Gui M, Wang X, Xiang Y. Cryo-EM structure of the SARScoronavirus spike glycoprotein in complex with its host cell receptor ACE2.PLoS Pathog. 2018;14(8):e1007236.
- Yan R, Zhang Y, Li Y, Xia L, Guo Y, Zhou Q. Structural basis for therecognition of the SARS-CoV-2 by full-length human ACE2. Science. 2020;367(6485):1444–8.
- Pinheiro DS, Santos RS, Jardim P, Silva EG, Reis AAS, Pedrino GR, et al. Thecombination of ACE I/D and ACE2 G8790A polymorphisms revelssusceptibility to hypertension: A genetic association study in Brazilianpatients. PLoS One. 2019;14(8):e0221248.
- South AM, Diz D, Chappell MC. COVID-19, ACE2 and the CardiovascularConsequences. Am J Physiol Heart Circ Physiol. 2020;318(5):H1084–H1090.
- Diaz JH. Hypothesis: angiotensin-converting enzyme inhibitors andangiotensin receptor blockers may increase the risk of severe COVID-19. JTravel Med. 2020.
- Zhou H, Zhang Y, Hu S, Shi C, Zhu P, Ma Q, et al. Melatonin protects cardiacmicrovasculature against ischemia/reperfusion injury via suppression ofmitochondrial fission-VDAC1-HK2-mPTP-mitophagy axis. J Pineal Res. 2017;63(1).
- Rocha-Ferreira E, Sisa C, Bright S, Fautz T, Harris M, Contreras Riquelme I,et al. Curcumin: Novel Treatment in Neonatal Hypoxic-Ischemic Brain Injury.Front Physiol. 2019;10:1351.
- Mukhopadhyay P, Rajesh M, Horvath B, Batkai S, Park O, Tanchian G, et al.Cannabidiol protects against hepatic ischemia/reperfusion injury byattenuating inflammatory signaling and response, oxidative/nitrative stress,and cell death. Free Radic Biol Med. 2011;50(10):1368–81.
- Lim HW, Lim HY, Wong KP. Uncoupling of oxidative phosphorylation bycurcumin: implication of its cellular mechanism of action. Biochem BiophysRes Commun. 2009;389(1):187–92.
- Berry BJ, Trewin AJ, Milliken AS, Baldzizhar A, Amitrano AM, Lim Y, et al.Optogenetic control of mitochondrial protonmotive force to impact cellularstress resistance. EMBO Rep. 2020;21(4):e49113.
- Zhao RZ, Jiang S, Zhang L, Yu ZB. Mitochondrial electron transport chain,ROS generation and uncoupling (Review). Int J Mol Med. 2019;44(1):3–15.
- Nunn AV, Bell J, Barter P. The integration of lipid-sensing and anti-inflammatory effects: how the PPARs play a role in metabolic balance.NuclRecept. 2007;5(1):1.
- Agarwal B, Stowe DF, Dash RK, Bosnjak ZJ, Camara AK. Mitochondrial targetsfor volatile anesthetics against cardiac ischemia-reperfusion injury. FrontPhysiol. 2014;5:341.
- Miro O, Barrientos A, Alonso JR, Casademont J, Jarreta D, Urbano-MarquezA, et al. Effects of general anaesthetic procedures on mitochondrial functionof human skeletal muscle. Eur J Clin Pharmacol. 1999;55(1):35–41.
- Sedlic F, Sepac A, Pravdic D, Camara AK, Bienengraeber M, Brzezinska AK,et al. Mitochondrial depolarization underlies delay in permeability transitionby preconditioning with isoflurane: roles of ROS and Ca2+. Am J PhysiolCell Physiol. 2010;299(2):C506–15.
- Ul Qamar MT, Alqahtani SM, Alamri MA, Chen LL. Structural basis of SARS-CoV-2 3CL(pro) and anti-COVID-19 drug discovery from medicinal plants. JPharm Anal. 2020;10(4):313–9.
- Ranjan A, Chauhan A, Gurnani M, Jindal T. Potential Phytochemicals asEfficient Protease Inhibitors of 2019-nCoV. Preprints. 2020:2020040240.
- Naoi M, Wu Y, Shamoto-Nagai M, Maruyama W. Mitochondria inNeuroprotection by Phytochemicals: Bioactive Polyphenols ModulateMitochondrial Apoptosis System, Function and Structure. Int J Mol Sci.2019;20(10).
- Mahase E. Covid-19: What do we know about “long covid”? BMJ. 2020;370:m2815.
- Anderson G, Maes M. Mitochondria and immunity in chronic fatiguesyndrome. Prog Neuropsychopharmacol Biol Psychiatry. 2020;103:109976.
- Sweetman E, Kleffmann T, Edgar C, de Lange M, Vallings R, Tate W. A SWATH-MS analysis of Myalgic Encephalomyelitis/Chronic Fatigue Syndromeperipheral blood mononuclear cell proteomes reveals mitochondrialdysfunction. J Transl Med. 2020;18(1):365.
- Collaboration NCDRF. Worldwide trends in body-mass index, underweight,overweight, and obesity from 1975 to 2016: a pooled analysis of 2416population-based measurement studies in 128.9 million children,adolescents, and adults. Lancet. 2017;390(10113):2627–42.
- Wallace DC. Bioenergetics in human evolution and disease: implications forthe origins of biological complexity and the missing genetic variation ofcommon diseases. Philos Trans R Soc Lond B Biol Sci. 2013;368(1622):20120267.
- Dyer O. Covid-19: Black people and other minorities are hardest hit in US.BMJ. 2020;369:m1483.
- Salameh Y, Bejaoui Y, El Hajj N. DNA Methylation Biomarkers in Aging andAge-Related Diseases. Front Genet. 2020;11:171