Μιτοχόνδρια και αμινοξέα
Βασικά αμινοξέα, μιτοχονδριακή ομοιόσταση και πρόληψη της ευθραστότητας στους ηλικιωμένους.
Agnese Segala (Τμήμα Μοριακής και Μεταφραστικής Ιατρικής, Πανεπιστήμιο της Μπρέσια), Enzo Nisoli (Τμήμα Ιατρικής Βιοτεχνολογίας και Μεταφραστικής Ιατρικής, Πανεπιστήμιο του Μιλάνου) Alessandra Valerio (Τμήμα Μοριακής και Μεταφραστικής Ιατρικής, Πανεπιστήμιο της Μπρέσια)
Γήρανση: μια λεπτή γραμμή μεταξύ φυσιολογίας και παθολογίας
Σε ένα πλαίσιο προοδευτικής γήρανσης του πληθυσμού, στην Ιταλία και στις δυτικές χώρες παρατηρούμε μια συνεχή αύξηση των παθολογικών καταστάσεων που σχετίζονται με την ηλικία. Μεταξύ αυτών, λόγω των σημαντικών επιπτώσεων στην ποιότητα της ατομικής ζωής και στην οικονομία της υγείας, εμφανίζεται το σύνδρομο ευθραυστότητας των ηλικιωμένων.
Είναι μια κατάσταση αυξημένης ευπάθειας, με προοδευτική αύξηση, η οποία εκθέτει το άτομο σε λειτουργική και γνωστική παρακμή, με μειωμένη ανεξαρτησία, αυξημένη ανάγκη για βοήθεια και νοσηλεία, καθώς και μεγαλύτερο κίνδυνο θανάτου (1,2).
Ιδιαίτερα επιβλαβής στην εξέλιξη του συνδρόμου είναι η φυσική παρακμή, η οποία βλέπει το βιολογικό του υπόστρωμα στην κατάσταση της σαρκοπενίας (3) με απώλεια μυϊκής μάζας και μυϊκής λειτουργίας (4).
Η θρεπτική κατάσταση επηρεάζει με σημαντικό τρόπο την ανάπτυξη της σαρκοπενίας και τη φυσική ευθραστότητα. Συγκεκριμένα, η σωστή πρόσληψη πρωτεΐνης είναι απαραίτητη για την πρόληψη ή τον περιορισμό της ανάπτυξης του μυϊκού ελλείμματος (5). Διαπιστώθηκε ότι ο μισός από το πληθυσμό των ηλικιωμένων στις ανεπτυγμένες χώρες δεν τρώει επαρκώς και συχνά εμφανίζει μια κατάσταση πρωτεϊνικού υποσιτισμού (6). Ως συνέπεια η σαρκοπενία, αποτελεί μια παθολογική κατάσταση διαρκώς διαδεδομένη που προκαλεί μεγάλο ενδιαφέρον στον τομέα της γεροντολογίας και της βασικής έρευνας.
Ο ρόλος της μιτοχονδριακής ομοιόστασης στην υγεία των μυών και της σαρκοπενίας στους ηλικιωμένους
Κεντρικής σημασίας στην παθοφυσιολογία της σαρκοπενίας είναι η απώλεια της μιτοχονδριακής λειτουργίας.
Τα μιτοχόνδρια είναι σημαντικοί παράγοντες σε πολλές κυτταρικές δραστηριότητες. Ειδικότερα, ο ρόλος τους στον ανεφοδιασμό των ενεργειακών υποστρωμάτων τα καθιστά απαραίτητα για τη διατήρηση της κυτταρικής ομοιόστασης.
Η σωστή λειτουργία του μιτοχονδριακού συστήματος έχει ανατεθεί σε συστήματα «ποιοτικού ελέγχου» που παρέχουν ισορροπημένη συνεργεία μεταξύ των διεργασιών μιτοχονδριογένεσης (σχηματισμός νέων οργανιδίων λειτουργικά ενεργών) και της μιτοφαγίας (αποδόμηση των κατεστραμμένων οργανιδίων).
Η διαδικασία της μιτοχονδριακής γένεσης περιλαμβάνει μηχανισμούς αντιγραφής μιτοχονδριακού DNA (mtDNA) και σύνθεση μιτοχονδριακών πρωτεϊνών, καθώς και μιτοχονδριακή δυναμική με φαινόμενα σύντηξης και σχάσης των ίδιων των οργανιδίων. Αυτά τα φαινόμενα συμβάλλουν στη λειτουργικότητα των μιτοχονδρίων στις διάφορες συνθήκες.
Είναι επομένως μια εξαιρετικά περίπλοκη διαδικασία, η οποία απαιτεί τη συνεργασία του πυρηνικού γονιδιώματος, που κωδικοποιεί τις περισσότερες από τις μιτοχονδριακές πρωτεΐνες, και του μιτοχονδριακού γονιδιώματος, που είναι υπεύθυνο τόσο για τη σύνθεση των μιτοχονδριακών tRNA και rRNA όσο και των πρωτεϊνών της αναπνευστικής αλυσίδας.
Πολυάριθμοι μηχανισμοί ελέγχου της γονιδιακής μεταγραφής εμπλέκονται στη ρύθμιση της μιτοχονδριογένεσης (7). Ο κύριος ρυθμιστής αυτής της σύνθετης αλυσίδας γεγονότων είναι ο συνενεργοποιητής μεταγραφής ενεργοποιητής πολλαπλασιασμού υπεροξεισώματος-υποδοχέας γ-συν-ενεργοποιητής 1-α (PGC-1α), ο οποίος με τη σειρά του ενεργοποιεί τον πυρηνικό αναπνευστικό παράγοντα 1 (NRF-1) που είναι υπεύθυνος για την έκφραση πυρηνικών γονιδίων που κωδικοποιούν για τα στοιχεία της αναπνευστικής αλυσίδας, των μιτοχονδριακών μεταφορέων και των μιτοχονδριακών ριβοσωμικών πρωτεϊνών. Επιπλέον, ο NRF-1 ρυθμίζει την έκφραση του παράγοντα μεταγραφής Α (Tfam), ένα κρίσιμο στοιχείο στον έλεγχο της αντιγραφής του mtDNA.
Η δραστικότητα του παράγοντα μεταγραφής PGC-1α προκαλείται μέσω της αποακετυλίωσης εκ μέρους του sirtuin SIRT1 (Το SIRT1 είναι ένα ένζυμο που βρίσκεται κυρίως στον κυτταρικό πυρήνα που αποακετυλιώνει μεταγραφικούς παράγοντες που συμβάλλουν στην κυτταρική ρύθμιση) και μέσω φωσφορυλίωσης από AMP- ενεργοποιημένη πρωτεΐνη κινάση (AMPK) σε απόκριση σε αλλαγές στα θρεπτικά συστατικά ή στην εξάντληση της ενέργειας.
Το AMPK δρα επίσης ως σύνδεσμος μεταξύ PGC-1α και mTORC1 (ή μηχανιστικός στόχος του συμπλέγματος ραπαμυκίνης 1), ένα στοιχείο κλειδί στη ρύθμιση της πρωτεϊνικής σύνθεσης και της ανάπτυξης των κυττάρων στην απόκριση σε θρεπτικά συστατικά.
Μέσω της αναστολής του TORC1, το AMPK μπορεί να προωθήσει την κάθαρση των ελαττωματικών μιτοχονδρίων διεγείροντας την αυτοφαγία. Η ερευνητική ομάδα απέδειξε ότι οι πολύπλοκες διεργασίες της μιτοχονδριογένεσης διαμορφώνονται από το νιτρικό οξείδιο (ΝΟ), ένα αέριο μεσολαβητή που παράγεται από το ένζυμο συνθετάση νιτρικού οξειδίου του αζώτου (eNOS) (8).
Επίσης αναδείχθηκε ο ρόλος της οδού σηματοδότησης eNOS-NO-SIRT1-PGC-1α στη ρύθμιση της μιτοχονδριακής ομοιόστασης σε σχέση με τον θερμιδικό περιορισμό ή τις ειδικές διατροφικές παρεμβάσεις (9,6). Αυτά τα αποτελέσματα υποδηλώνουν ότι η ενεργοποίηση των οδών σηματοδότησης που αποτελούνται από ΝΟ, AMPK, SIRT1 και mTORC1 είναι μέρος ενός σύνθετου κυκλώματος αμοιβαίας ρύθμισης, που δεν έχει ακόμη κατανοηθεί πλήρως .
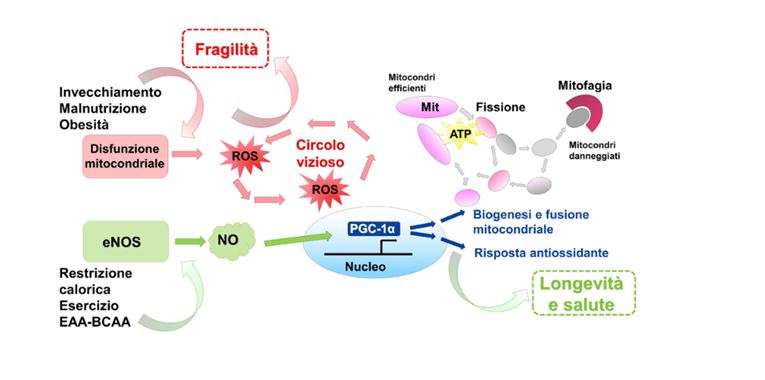
Σε αυτό το σημείο είναι σημαντικό να τονισθεί, όπως αναφέρθηκε προηγουμένως, τις αμέτρητες αποδείξεις ότι η μιτοχονδριακή δυσλειτουργία, η οποία χαρακτηρίζει τις διαδικασίες γήρανσης, εκτός από την ενεργειακή ανισορροπία με τη μειωμένη παραγωγή ATP και την αύξηση του κλάσματος AMP/ATP, προκαλεί αύξηση στις ελεύθερες ρίζες ή είδη αντιδραστικού οξυγόνου (ROS) (Εικ. 1).

Μιτοχόνδρια και αμινοξέα
Ως αποτέλεσμα της μειωμένης έκφρασης του PGC-1α, ενεργοποιείται η οδός σηματοδότησης του πυρηνικού παράγοντα NF-κB, η οποία εμπλέκεται σε περαιτέρω βλάβη στη δραστηριότητα των μιτοχονδρίων-(10) και στην ενεργοποίηση διεργασιών χρόνιας φλεγμονής χαμηλού βαθμού που χαρακτηρίζουν τη γήρανση .
Επιπλέον, η αναστολή του ίδιου του mTORC1, που προκύπτει από τη μειωμένη έκφραση του PGC-1α, έχει αρνητικό αντίκτυπο στη μιτοχονδριογένεση καθώς και στη λειτουργικότητα των μιτοχονδρίων όπως αναφέρθηκε παραπάνω.
Η μειωμένη ενεργοποίηση του mTORC1 καθορίζει τη μείωση της πρωτεϊνικής σύνθεσης, καθώς και των λιπιδίων και των νουκλεοτιδίων. Σε συνθήκες κυτταρικής γήρανσης και, γενικότερα, γήρανσης (ιδίως στα μυοκύτταρα ηλικιωμένων σαρκοπενικών και εύθραυστων ασθενών) οι διαδικασίες αυτοφαγίας, που συνήθως είναι υπεύθυνες για την εξάλειψη των δυσλειτουργικών οργανιδίων και παραγωγών ROS, είναι ανεπαρκές (11).
Η συσσώρευση κατεστραμμένων μιτοχονδρίων σε αυτό το πλαίσιο και η μιτοφαγία προάγει την εξωκυτταροπλασματική απελευθέρωση πολλαπλών ουσιών (Ν-φορμυλ πεπτίδια, καρδιολιπίνες) και θραύσματα mtDNA, καθώς και υπολείμματα κατεστραμμένων οργανιδίων, τα οποία διεγείρουν τη φλεγμονή.
Τα επίπεδα κυκλοφορίας του mtDNA αυξάνονται προοδευτικά με την ηλικία και συσχετίζονται με την ποσότητα των προφλεγμονωδών κυτοκινών, όπως IL-6 και TNF-α, που συνήθως υπάρχουν τόσο στο πλάσμα όσο και σε διάφορους ιστούς μεταβολικά ενεργούς, όπως οι μυώνες των ηλικιωμένων ατόμων (10).
Μελέτες γονιδιακής έκφρασης έχουν δείξει ότι η εμπλοκή του μιτοχονδριακού ελλείμματος στις διαδικασίες γήρανσης είναι ειδική για τον ιστό και ιδιαίτερα σχετική σε ιστούς που εξαρτώνται έντονα από τον οξειδωτικό μεταβολισμό, όπως ο εγκέφαλος, η καρδιά και ο σκελετικός μυς.
Έχοντας μετα-μιτωτική φύση, τα μυοκύτταρα και οι νευρώνες δεν μπορούν να εξαλείψουν τα οργανίδια που έχουν υποστεί βλάβη στις διαδικασίες της κυτταρικής διαίρεσης. Ως εκ τούτου, η ομοιόσταση αυτών των κυττάρων εξαρτάται αποκλειστικά από τα συστήματα «ποιοτικού ελέγχου» των μιτοχονδρίων.
Για το λόγο αυτό, η βλάβη του μιτοχονδριακού συστήματος ανανέωσης στον σκελετικό μυ, με επακόλουθο βιοενεργειακό έλλειμμα, οξειδωτικό στρες και βλάβη στο mtDNA, οδηγεί στην απώλεια μυϊκών ινών και στην ανάπτυξη σαρκοπενίας και ευθραυστότητας (Εικ. 1).
Στρατηγικές παρέμβασης για τη σαρκοπενία: ο ρόλος των αμινοξέων
Με βάση τους περιγραφόμενους παθογόνους μηχανισμούς, προτείνονται πολλές στρατηγικές παρέμβασης, μελετημένες κυρίως σε ζωικά μοντέλα και μπορούν να ταξινομηθούν ουσιαστικά σε φαρμακολογικές και μη φαρμακολογικές στρατηγικές.
Μεταξύ των φαρμακολογικών προσεγγίσεων μπορούμε να αναφέρουμε την ενεργοποίηση του SIRT1 με ενώσεις που ονομάζονται STACs (Sirt1-activating com-pound), οι οποίες ασκούν την επίδρασή τους μέσω της αλλοστερικής ενεργοποίησης της δράσης της αποακετυλάσης του SIRT1 (12). Η αύξηση του NAD+ επιτεύχθηκε μέσω της συμπλήρωσης των πρόδρομων του, όπως η Νικοτιναμίδη ριβοσίδη, φαίνεται μια έγκυρη εναλλακτική λύση για την προώθηση της λειτουργίας του sirtuin (13).
‘Έχουν υποτεθεί και άλλες φαρμακολογικές παρεμβάσεις για τη βελτίωση της μιτοχονδριακής δυσλειτουργίας που συνδέεται με τη γήρανση, όπως η επιλεκτική επαγωγή του PGC-1α σε διαφορετικούς ιστούς με ZLN005, την αναστολή του ενζύμου GSK-3, το οποίο έχει ως αποτέλεσμα την προώθηση της μιτοχονδρογένεσης που προκαλείται από PGC-1α , μέσω μιας ένωσης γνωστής ως SB216763, καθώς και αύξηση της έκφρασης του eNOS με ενώσεις χαμηλού μοριακού βάρους, όπως το AVE3085, οι οποίες επάγουν PGC-1α και μιτοχονδριογένεση (6).
Μεταξύ των μη φαρμακολογικών παρεμβάσεων έχει αποδειχθεί ότι η σωματική άσκηση, τόσο οξεία όσο και χρόνια, είναι σε θέση να αυξήσει τη μιτοχονδριογένεση, βελτιώνοντας τις μιτοχονδριακές λειτουργίες όχι μόνο στα μυϊκά κύτταρα αλλά και σε πολλούς άλλους τύπους κυττάρων (14).
Ομοίως, ο περιορισμός των θερμίδων έχει θετικά αποτελέσματα στη διατήρηση και αποκατάσταση των μιτοχονδριακών λειτουργιών και της άμυνας κατά των ROS σε πολλούς ιστούς, τόσο σε πειραματόζωα όσο και σε ανθρώπους (6,9). Ωστόσο, ένα σχήμα περιορισμού των θερμίδων που παρατείνεται με την πάροδο του χρόνου απαιτεί μια προσπάθεια που είναι δύσκολο να διατηρηθεί, καθώς και αντενδείκνυται στους ηλικιωμένους. Πιο πρόσφατα έχει προταθεί μια προσέγγιση αντικατάστασης με διατροφικές λύσεις που μιμούνται νηστεία, η οποία φαίνεται να μπορεί να επιτύχει μεγαλύτερη αποδοχή από τους ασθενείς (15).
Σε αυτό το πλαίσιο εισάγεται η χρήση διατροφικής συμπλήρωσης με ειδικά μίγματα αμινοξέων. Είναι ενδιαφέρον, από αυτή την άποψη, να θυμόμαστε ότι ξεκινώντας από ζύμες έως και τα ποντίκια, έχει αποδειχθεί η αποτελεσματικότητα των συμπληρωμάτων διατροφής με βάση αμινοξέα διακλαδισμένης αλυσίδας (BCAAs), λευκίνη, ισολευκίνη και βαλίνη.
Τα BCAAs είναι απαραίτητα αμινοξέα (EAAs), τα οποία παίζουν θεμελιώδη ρόλο στη σύνθεση πρωτεϊνών, στερολών, κετονικών σωμάτων και γλυκόζης. Αποτελούν το 21% της συνολικής πρωτεΐνης του σώματος και το 35% των EAAs μυϊκής πρωτεΐνης. Επιπλέον, τα ελεύθερα BCAA που αντιπροσωπεύουν ένα μικρό κλάσμα των συνολικών BCAAs, που συσσωρεύονται κυρίως στους σκελετικούς μύες, δρουν ως μεταβολικοί ρυθμιστές και όχι μόνο ως συστατικά των πρωτεϊνών.
Τα BCAA προσλαμβανόμενα με τη διατροφή απορροφώνται στην εγγύ νήστιδα και τα περισσότερα φτάνουν ανέπαφα στη συστηματική κυκλοφορία. Περίπου το 95-99% των εκκρινόμενων BCAA απορροφώνται εκ νέου από τα νεφρά. Σε αντίθεση με αυτό που συμβαίνει για άλλα αμινοξέα, για τα BCAA, το μεγαλύτερο μέρος του καταβολισμού δεν πραγματοποιείται στο ήπαρ, αλλά στον σκελετικό μυ, τον εγκέφαλο και τον λευκό λιπώδη ιστό, και μπορεί να παράγει διαφορετικά τελικά προϊόντα, όπως το acetil-CoA, μερικά ενδιάμεσα του κύκλου Krebs, οι μεταβολίτες όπως το β-υδροξυ-β-μεθυλοβουτυρικό και τα σώματα κετόνης.
Συγκεκριμένα, η λευκίνη είναι ένα κετογονικό αμινοξύ, ενώ η βαλίνη είναι ένα γλυκογονικό αμινοξύ, ενώ η ισολευκίνη είναι τόσο ένα γλυκογονικό οσο και ένα κετογονικό αμινοξύ. Δεδομένου ότι οι μύες δεν είναι γλυκογονικοί ιστοί, το 3-υδροξυ-βουτυρικό (μεταβολικό ενδιάμεσο της βαλίνης) είναι ικανό να μεταναστεύσει στο ήπαρ και στα νεφρά όπου μπορεί να χρησιμοποιηθεί ως υπόστρωμα για παραγωγή γλυκόζης.
Τα BCAA μπορούν να χρησιμοποιηθούν από τον οργανισμό μας τόσο με καταβολικό όσο και με αναβολικό τρόπο. Σε συνθήκες νηστείας, το γλυκαγόνο, η αδρεναλίνη, η νοραδρεναλίνη, η κορτιζόλη και η αυξητική ορμόνη αυξάνουν την κυτταρική χρήση των BCAAs με καταβολικό τρόπο, προάγοντας την οξείδωση τους για την παραγωγή ATP.
Αντίθετα, υψηλά επίπεδα κυκλοφορούντων BCAA προάγουν τη σύνθεση πρωτεϊνών και την κυτταρική ανάπτυξη (16). Μεταξύ των μηχανισμών που εμπλέκονται στα φαινόμενα που προκύπτουν από την πρόσληψη BCAA, σίγουρα παίζει σημαντικό ρόλο το σύστημα σηματοδότησης mTORC1.
Υπό αυτήν την έννοια, φαίνεται να έχει ιδιαίτερη σημασία η παρατήρησή ότι η συμπλήρωση με ένα συγκεκριμένο μείγμα βασικών αμινοξέων, εμπλουτισμένων σε BCAAs (BCAA-en-riched μείγμα, BCAAem),, είναι σε θέση να διεγείρει τη δραστηριότητα του mTORC1, προωθώντας την έκφραση του eNOS και τη παραγωγή ΝΟ, καθώς και την έκφραση του PGC-1α και την ενεργοποίηση του SIRT1 και ευνοόντας τη μιτοχονδριογένεση στα μυϊκά κύτταρα (καρδιακά και σκελετικά) και στον μυ των ποντικών προχωρημένης ηλικίας (17).
Έχει δειχθεί ότι, η γονιδιακή σίγαση του eNOS μειώνει την ικανότητα του μείγματος να ενεργοποιεί το mTORC1 in vitro και ότι η διατροφική συμπλήρωση με BCAAem δεν είναι σε θέση να ενεργοποιήσει το mTORC1 σε eNOS knockout ζωϊκά μοντέλα. Αυτό υποδηλώνει, επομένως, την παρουσία ενός μηχανισμού θετικής ανατροφοδότησης μεταξύ του eNOS και του mTORC1 στη βάση των επιδράσεων από το μίγμα BCAAem.
Ιδιαίτερο ενδιαφέρον παρουσιάζει η παρατήρηση ότι το μείγμα είναι σε θέση να μειώσει την ποσότητα ROS που συσσωρεύεται με την ηλικία στους μυϊκούς ιστούς, μέσω της αυξημένης έκφρασης των πρωτεϊνών που εμπλέκονται στο σύστημα άμυνας των ελεύθερων ριζών, όπως SOD1, SOD2, καταλάση και GPx1 (17 ). Ακολουθεί ότι η συμπλήρωση με EAA-BCAA μιμείται τους μηχανισμούς που χρησιμοποιεί το CR και η άσκηση, ασκώντας ένα παρόμοιο αντιγηραντικό αποτέλεσμα (Εικ. 1).
Οι ευεργετικές δράσεις των BCAA και, γενικότερα, των EAAs εκτελούνται σε ένα ευρύ φάσμα ιστών και συστημάτων, βελτιώνοντας τις ανοσολογικές λειτουργίες (11), την ομοιόσταση της γλυκόζης και την ευαισθησία στην ινσουλίνη (11), τις λειτουργίες της καρδιάς και των νεφρών σε διαβητικούς ασθενείς, τη διαδικασία επούλωσης από πληγές, τις γνωστικές λειτουργίες (6).
Συγκεκριμένα, στο επίπεδο των μυών τα BCAAs επιτρέπουν τη διατήρηση του μεγέθους των ινών με βελτίωση της μυϊκής ατροφίας, καθορίζοντας μια γενική θετική επίδραση στη φυσική απόδοση σε όρους αντοχής και συντονισμού (6).
Με την αύξηση της ηλικίας υπάρχει μια αλλαγή στη σύνθεση του σώματος, με αύξηση της ολικής μάζας λίπους και μερικές φορές πολύ έντονη μείωση της μυϊκής και οστικής μάζας. Η απώλεια μυϊκής μάζας, σε συνδυασμό με την ποσότητα και την ποιότητα των συσταλτικών πρωτεϊνών, συμβάλλει στην αναπηρία και την ευθραστότητα, την απώλεια καθημερινών δραστηριοτήτων και λειτουργικών δεξιοτήτων και τον αυξημένο κίνδυνο πτώσεων και καταγμάτων (18).
Το μυϊκό σύστημα των ηλικιωμένων και κυρίων αυτών που έχουν σαρκοπενία, παρουσιάζει μια κατάσταση ανισορροπίας μεταξύ σύνθεσης και καταβολισμού των πρωτεϊνών που οδηγεί σε μια κατάσταση αναβολικής αντίστασης (19).
Η ικανότητα σύνθεσης πρωτεϊνών (μετρούμενη σε g/kg σωματικού βάρους/ημέρα) μειώνεται δραστικά με την ηλικία, από 17,4 στα νεογέννητα σε 6,9 στα νήπια, σε 3 στους ενήλικες, φτάνοντας μια τιμή ίση με 1,9 στους ηλικιωμένους (16). Ομοίως με την ηλικία, επίσης αυξάνεται ο καταβολισμός των πρωτεϊνών (18).
Σε φυσιολογικές συνθήκες, η ποσότητα των πρωτεϊνών που καταναλώνεται κανονικά από νεαρά άτομα (20-25 g, αποτελούμενη από 8-9 g EAA με 2,5-3,5 g λευκίνης) είναι επαρκής για να διεγείρει μαζικά τη σύνθεση πρωτεϊνών στους μυς. Αντίθετα, σε ηλικιωμένα άτομα, στα οποία για διάφορους λόγους η ημερήσια πρόσληψη πρωτεΐνης είναι συνήθως ανεπαρκής (δυσκολία στην πέψη και απορρόφηση του κρέατος, ελαττωματική μάσηση, μειωμένη εντερική απορρόφηση και εμφανείς τροποποιήσεις του εντερικού μικροβιώματος) και ιδιαίτερα σε ηλικιωμένους με σαρκοπενία και αδύναμους, οι πρωτεΐνες που λαμβάνονται με τη διατροφή δεν είναι σε θέση να διεγείρουν τη σύνθεση των μυϊκών πρωτεϊνών με τον μέγιστο τρόπο, οδηγώντας σε προοδευτική μυϊκή ατροφία.
Δύο πιθανοί μηχανισμοί που συμβάλλουν στην αναβολική αντίσταση του μυός των ηλικιωμένων ατόμων αντιπροσωπεύονται από μια σταδιακή μείωση της σωματικής δραστηριότητας και από την κατάσταση της συστηματικής φλεγμονής χαμηλού βαθμού (20).
Χρόνια συμπλήρωση διατροφής με συγκεκριμένα μείγματα ΕΑΑ προάγει μια αντιστροφή αυτών των εκφυλιστικών. διεργασιών με αποτέλεσμα τη μετάβαση από μεταβολικές διεργασίες σε αναβολικές διαδικασίες σε μυϊκό επίπεδο.
Αυτό οδηγεί σε γενική αύξηση της αδύνατης μάζας που συνοδεύεται από βελτίωση της λειτουργίας των μυών και αύξηση της ευαισθησίας στην ινσουλίνη σε σαρκοπενικούς ηλικιωμένους ασθενείς (18). Οι ισορροπημένοι συνδυασμοί των EAA-BCAA, δρουν ευνοϊκά στη μυϊκή μάζα σε συνθήκες ακινησίας ή γήρανσης, μέσω της διέγερσης της πρωτεϊνικής σύνθεσης και της μείωσης της πρωτεόλυσης, αλλά επίσης και πιο συγκεκριμένα μέσω της επαγωγής μιτοχονδριαγένεσης με αύξηση των μιτοχονδριακών λειτουργιών, την παραγωγή ενέργειας με τη μορφή ATP, των ενζύμων αντι-ROS.
Γήρανση: μια διαδικασία που δεν έχει ακόμη ορισθεί
Η μελέτη της γήρανσης πάντα γοήτευε τον άνθρωπο και πολλές ερευνητικές ομάδες αποφάσισαν να επενδύσουν τη δραστηριότητά τους σε αυτόν τον τομέα, με στόχο όχι μόνο την αποκάλυψη των περίπλοκων μηχανισμών που εμπλέκονται, αλλά και την ανακάλυψη νέων πιθανών θεραπευτικών προσεγγίσεων, που στοχεύουν στη διατήρηση και βελτίωση της φυσικής και γνωστικής εξασθένησης.
Ωστόσο, υπάρχουν πολλές άλυτες πτυχές:
1) Πόσο μακροζωία και υγεία μπορούν να συμβιβαστούν;
2) Ποιες είναι οι προσεγγίσεις που επιτρέπουν τη διατήρηση των γνωστικών και φυσικών λειτουργιών κατά τη διάρκεια της ζωής;
3) Ποιοι είναι οι μεσολαβητές της συστημικής ενεργειακής ομοιόστασης;
4) Ποιες είναι οι διαφορές στα φύλα των μηχανισμών που εμπλέκονται στη ρύθμιση της κυτταρικής βιοενέργειας και στη μεταβολική ικανότητα των μιτοχονδρίων (21) και, συνεπώς, ποιες διαφορές στη θεραπεία μεταξύ ανδρών και γυναικών;
Πέρα από αυτά τα ερωτήματα που παραμένουν ανοιχτά, το διατροφικό συμπλήρωμα με αμινοξέα έχει αποδειχθεί, εκτός από το ότι είναι πολύ καλά ανεκτό και ασφαλές, ιδιαίτερα αποτελεσματικό στην προώθηση του μιτχονδριακού μεταβολισμού και στη ρύθμιση της γονιδιακής έκφρασης όχι μόνο σε επίπεδο μυών, προωθώντας βελτιώσεις στις διαδικασίες της φλεγμονής και ανοσοποιητικού στην αποκατάσταση των πληγών.
Εικόνα 1. Επιδράσεις αντιγήρανσης που σχετίζονται με τη διατήρηση μιας ισορροπημένης μιτοχονδριακής ομοιόστασης. Οι διαδικασίες γήρανσης, ιδίως όταν σχετίζονται με την υπερβολική πρόσληψη θερμίδων και τη σωματική αδράνεια ή / και τον υποσιτισμό πρωτεϊνών, είναι η βάση για την παραγωγή ROS και φλεγμονωδών φαινομένων που ευνοούν τις χρόνιες ασθένειες και την έναρξη του συνδρόμου ευθραστότητας. Ο περιορισμός θερμίδων, η άσκηση και η συμπλήρωση διατροφής με ισορροπημένους τύπους EAA-BCAA αυξάνουν την έκφραση και τη λειτουργία του ενζύμου eNOS και την παραγωγή νιτρικού οξειδίου (ΝΟ). Η οδός σηματοδότησης που συντονίζεται από το eNOS-NO-PGC1α προωθεί την μιτοχονδριακή ανανέωση με ικανοποιητική παραγωγή ενέργειας με τη μορφή ΑΤΡ, και ενεργοποιεί την ενδογενή αντιοξειδωτική απόκριση. Αυτή η προσαρμοστική διαδικασία προάγει την επιβίωση των κυττάρων και παρατείνει τη ζωή σε καλή υγεία
ΒΙΒΛΙΟΓΡΑΦΙΑ
Clegg A, Young J, Iliffe S, et al. Frailty in older people. Lancet 2013;381:752-62.
Cesari M, Calvani R, Marzetti E. Frailty in older persons. Clin Geriatr Med 2017;33:293-303.
Landi F, Calvani R, Cesari M, et al. Sarcopenia as the biological sub-strate of physical frailty. Clin Geriatr Med 2015;31:367-74.
Cruz-Jentoft AJ, Bahat G, Bauer J, et al. Sarcopenia: revised European consensus on definition and diag-nosis. Age Ageing 2019;48:16-31.
Cruz-Jentoft AJ, Kiesswetter E, Drey M, et al. Nutrition, frailty, and sarcopenia. Aging Clin Exp Res 2017;29:43-8.
Valerio A, D’Antona G, Nisoli E. Branched-chain amino acids, mi-tochondrial biogenesis, and health-span: an evolutionary perspective. Aging (Albany NY) 2011;3:464-78.
Scarpulla RC, Vega RB, Kelly DP. Transcriptional integration of mito-chondrial biogenesis Regulation of mitochondrial biogenesis. Trends Endocrinol Metab 2012;23:459-66.
Nisoli E, Clementi E, Paolucci C, et al. Mitochondrial biogenesis in mam-mals: the role of endogenous nitric oxide. Science 2003;299:896-9.
Nisoli E, Tonello C, Cozzi V, et al. Calorie restriction promotes mito-chondrial biogenesis by inducing the expression of eNOS. Science 2005;310:314-7.
Picca A, Calvani R, Bossola M, et al. Update on mitochondria and muscle aging: all wrong roads lead to sarco-penia. Biol Chem 2018;399:421-36.
Bifari F, Ruocco C, Decimo I, et al. Amino acid supplements and metabolic health: a potential inter-play between intestinal microbiota and systems control. Genes Nutr 2017;12:27.
Schultz MB, Rinaldi C, Lu Y, et al. Molecular and cellular characteriza-tion of SIRT1 allosteric activators. In: Protein acetylation. New York: Hu-mana 2019, pp. 133-49.
Cantó C, Houtkooper RH, Pirinen E, et al. The NAD + precursor nicotin-amide riboside enhances oxidative metabolism and protects against high-fat diet induced obesity. Cell Metab 2012;15:838-47.
Nisoli E, Valerio A. Healthspan and longevity in mammals: a family game for cellular organelles? Curr Pharm Des 2014;20:5663-70.
Mattson MP, Longo VD, Harvie M. Impact of intermittent fasting on health and disease processes HHS Public Access. Ageing Res Rev 2017;39:46-58.
Bifari F, Nisoli E. Branched-chain amino acids differently modu-late catabolic and anabolic states in mammals: a pharmacologi-cal point of view. Br J Pharmacol 2017;174:1366-77.
D’Antona G, Ragni M, Cardile A, et al. Branched-chain amino acid supplementation promotes survival and supports cardiac and skeletal muscle mitochondrial biogenesis in middle-aged mice. Cell Metab 2010;12:362-72.
Solerte SB, Gazzaruso C, Bon-acasa R, et al. Nutritional supple-ments with oral amino acid mixtures increases whole-body lean mass and insulin sensitivity in elderly sub-jects with sarcopenia. Am J Cardiol 2008;101:S69-S77.
Shad BJ, Thompson JL, Breen L. Does the muscle protein synthetic response to exercise and amino ac-id-based nutrition diminish with ad-vancing age? A systematic review. Am J Physiol Endocrinol Metab 2016;311:803-17.
Cholewa JM, Dardevet D, Lima-Soares F, et al. Dietary proteins and amino acids in the control of the muscle mass during immobiliza-tion and aging: role of the MPS re-sponse. Amino Acids 2017;49:811-20.
Ventura-Clapier R, Moulin M, Piquereau J, et al. Mitochon-dria: a central target for sex dif-ferences in pathologies. Clin Sci 2017;131:803-22