Η ερευνητική θεραπεία ενζυμικής υποκατάστασης της Sanofi δείχνει κλινικώς σημαντική βελτίωση σε κρίσιμες εκδηλώσεις της νόσου Pompe όψιμης έναρξης

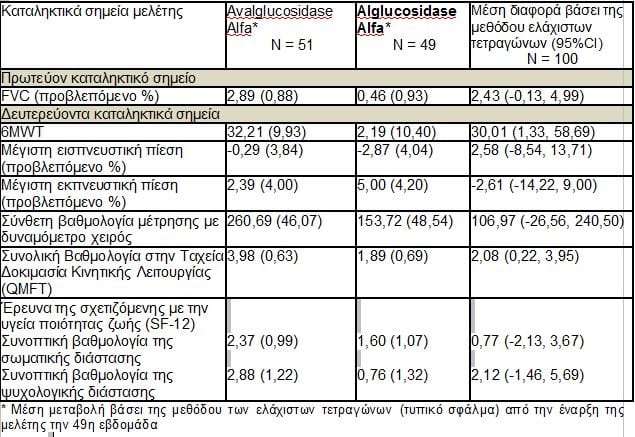
Η avalglucosidase alfa κατέδειξε βελτίωση 2,4 μονάδων στο προβλεπόμενο ποσοστό της βιαίως εκπνεόμενης ζωτικής χωρητικότητας, μία σημαντική παράμετρο της αναπνευστικής λειτουργίας στη νόσο Pompe, σε σύγκριση με την alglucosidase alfa (καθιερωμένη θεραπεία) .
Οι ασθενείς που έλαβαν θεραπεία με avalglucosidase alfa διένυσαν κατά 30 μέτρα μεγαλύτερη απόσταση σε σύγκριση με τους ασθενείς που έλαβαν την καθιερωμένη θεραπεία, όπως μετρήθηκε βάσει της 6-λεπτης δοκιμασίας βάδισης.
Αναμένεται να κατατεθούν εγκριτικοί φάκελοι στις ρυθμιστικές αρχές ανά τον κόσμο το δεύτερο εξάμηνο του 2020.
ΠΑΡΙΣΙ – 16 Ιουνίου 2020 – Η avalglucosidase alfa, η ερευνητική θεραπεία ενζυμικής υποκατάστασης (ERT) της Sanofi, κατέδειξε κλινικώς σημαντική βελτίωση σε κρίσιμες εκδηλώσεις (αναπνευστική δυσλειτουργία και μειωμένη κινητικότητα) της νόσου Pompe όψιμης έναρξης, σύμφωνα με τα αποτελέσματα από τη μελέτη Φάσης 3 που παρουσιάστηκε σε επιστημονική εκδήλωση που διοργανώθηκε από τη Sanofi. Η avalglucosidase alfa πέτυχε το πρωτεύον καταληκτικό σημείο καταδεικνύοντας μη-κατωτερότητα όσον αφορά στη βελτίωση της αναπνευστικής λειτουργίας σε σύγκριση με την alglucosidase alfa (καθιερωμένη θεραπεία) σε ασθενείς με νόσο Pompe όψιμης έναρξης. Αυτά τα δεδομένα θα αποτελέσουν τη βάση για την κατάθεση εγκριτικών φακέλων σε ρυθμιστικές αρχές ανά τον κόσμο, η οποία αναμένεται να πραγματοποιηθεί το δεύτερο εξάμηνο του τρέχοντος έτους.
Ο Οργανισμός Τροφίμων και Φαρμάκων (FDA) των ΗΠΑ απέδωσε τον χαρακτηρισμό Καινοτόμου Θεραπείας [Breakthrough Therapy] και Ταχείας Αξιολόγησης [Fast Track] στην avalglucosidase alfa για τη θεραπεία ασθενών με νόσο Pompe.
Το πρωτεύον καταληκτικό σημείο της μελέτης αξιολόγησε τη μεταβολή της λειτουργίας των αναπνευστικών μυών με βάση την ποσοστιαία προβλεπόμενη βιαίως εκπνεόμενη ζωτική χωρητικότητα (FVC) σε όρθια θέση.
Οι ασθενείς που έλαβαν θεραπεία με avalglucosidase alfa εμφάνισαν μεγαλύτερη βελτίωση 2,4 μονάδων στην ποσοστιαία προβλεπόμενη FVC σε σύγκριση με τους ασθενείς που έλαβαν την καθιερωμένη θεραπεία (95% CI, -0,13 / 4,99), μια αριθμητική βελτίωση της αναπνευστικής λειτουργίας που υπερέβη την παράμετρο της μη-κατωτερότητας που περιλαμβανόταν στον σχεδιασμό της μελέτης (p=0,0074).
Το πρωτεύον καταληκτικό σημείο αξιολογήθηκε και ως προς την ανωτερότητα. Δεν επετεύχθη στατιστικά σημαντική της ανωτερότητα για το σκέλος θεραπείας με avalglucosidase alfa (p=0,0626). Ως εκ τούτου, σύμφωνα με την ιεράρχηση του πρωτοκόλλου της μελέτης, δεν διενεργήθηκε τυπικός στατιστικός έλεγχος για όλα τα δευτερεύοντα καταληκτικά σημεία.
Ένα κύριο δευτερεύον καταληκτικό σημείο της μελέτης αξιολογούσε την κινητικότητα με βάση την 6-λεπτη δοκιμασία βάδισης (6MWT). Οι ασθενείς που έλαβαν θεραπεία με avalglucosidase alfa διένυσαν μεγαλύτερη απόσταση κατά 30 μέτρα (95% CI, 1,33 / 58,69) σε σύγκριση με τους ασθενείς που έλαβαν την καθιερωμένη θεραπεία. Άλλα δευτερεύοντα καταληκτικά σημεία αξιολόγησαν την ισχύ των αναπνευστικών μυών, την κινητική λειτουργία και την ποιότητα ζωής.

«Η νόσος Pompe ενδέχεται να είναι εξουθενωτική, καθώς προκαλεί προοδευτική αδυναμία των μυών.
Είναι σημαντικό οι δυνητικές νέες θεραπευτικές επιλογές να προσφέρουν στους ασθενείς κλινικώς σημαντική βελτίωση πολλών παραμέτρων της αναπνευστικής και κινητικής λειτουργίας», δήλωσε ο Jordi Diaz-Manera, M.D., Ph.D., Καθηγητής Νευρομυϊκών Διαταραχών, Μεταγραφικής Ιατρικής και Γενετικής στο Ερευνητικό Κέντρο John Walton για τις Μυικές Δυστροφίες του Πανεπιστημίου του Νιούκαστλ στο Ηνωμένο Βασίλειο. «Τα ευρήματα από τη μελέτη Φάσης 3 είναι ιδιαίτερα ενθαρρυντικά και προστίθενται στο αυξανόμενο σύνολο κλινικών δεδομένων που καταδεικνύουν τη δυνατότητα της avalglucosidase alfa να αποτελέσει μια νέα θεραπευτική επιλογή για την αντιμετώπιση των κλασικών συμπτωμάτων της συγκεκριμένης νόσου».
Παράλληλα, παρουσιάστηκαν αποτελέσματα από μια προκαθορισμένη προκαταρκτική ανάλυση που αξιολόγησε το προβλεπόμενο ποσοστό της εκπνεόμενης ζωτικής χωρητικότητας (FVC) και την 6-λεπτη δοκιμασία βάδισης (6MWT) στους ασθενείς που έκαναν αλλαγή (ασθενείς αλλαγής) την 49η εβδομάδα από την καθιερωμένη θεραπεία σε θεραπεία με avalglucosidase alfa για την ανοιχτή φάση επέκτασης της μελέτης. Λόγω διαδοχικής ένταξης, τα αποτελέσματα της προκαταρκτικής ανάλυσης κατά την παρουσίαση των δεδομένων ήταν διαθέσιμα στις 97 εβδομάδες για 20 από τους 49 ασθενείς αλλαγής όσον αφορά στην ποσοστιαία προβλεπόμενη εκπνεόμενη ζωτική χωρητικότητα (FVC), και για 21 από τους 49 ασθενείς αλλαγής όσον αφορά στην 6-λεπτη δοκιμασία βάδισης (6MWT). Σε αυτούς τους ασθενείς αλλαγής, η θεραπεία με avalglucosidase alfa κατέδειξε βελτίωση 0,15 μονάδων στην FVC (95% CI, -1,95 / 2,25) και βελτίωση 23,32 μέτρων στην6MWT (95% CI, -3,87 / 50,51).
«Είμαστε ικανοποιημένοι που η avalglucosidase alfa έδειξε κλινικώς σημαντική βελτίωση τόσο της αναπνευστικής λειτουργίας όσο και της κινητικότητας, όπως υπολογίστηκαν με βάση τις τεκμηριωμένες τυπικές μετρήσεις των εκβάσεων της νόσου Pompe», δήλωσε ο John Reed, M.D., Ph.D., Global Head of Research and Development της Sanofi. «Τα αποτελέσματα αυτά ενισχύουν τη φιλοδοξία μας να καθιερώσουμε την avalglucosidase alfa ως νέα καθιερωμένη θεραπεία για τη νόσο Pompe».
Το προφίλ ασφάλειας της avalglucosidase alfa βρέθηκε συγκρίσιμο με αυτό της καθιερωμένης θεραπείας.
Κατά τη διάρκεια της διπλής τυφλής περιόδου 49 εβδομάδων, 44 ασθενείς στο σκέλος θεραπείας με avalglucosidase alfa και 45 ασθενείς στο σκέλος της καθιερωμένης θεραπείας εμφάνισαν ανεπιθύμητες ενέργειες. Υπήρξαν 6 ασθενείς με σοβαρές ανεπιθύμητες ενέργειες στο σκέλος θεραπείας με avalglucosidase alfa και 7 ασθενείς στο σκέλος της καθιερωμένης θεραπείας. Λιγότεροι ασθενείς εμφάνισαν σοβαρές ανεπιθύμητες ενέργειες στο σκέλος θεραπείας με avalglucosidase alfa (8 ασθενείς, συμπεριλαμβανομένου 1 ασθενή με δυνητικά σχετιζόμενες με τη θεραπεία σοβαρές ανεπιθύμητες ενέργειες) σε σύγκριση με το σκέλος της καθιερωμένης θεραπείας (12 ασθενείς, συμπεριλαμβανομένων 3 ασθενών με δυνητικά σχετιζόμενες με τη θεραπεία σοβαρές ανεπιθύμητες ενέργειες).
Στο σκέλος της καθιερωμένης θεραπείας της μελέτης, 4 ασθενείς εμφάνισαν ανεπιθύμητες ενέργειες που οδήγησαν σε αποχώρηση από την μελέτη και 1 ασθενής κατέληξε λόγω οξέος εμφράγματος του μυοκαρδίου (μη σχετιζόμενου με τη θεραπεία). Στο σκέλος της θεραπείας με avalglucosidase alfa, δεν παρατηρήθηκε διακοπή θεραπείας ή θάνατος ασθενών. Λιγότεροι ασθενείς στο σκέλος θεραπείας με avalglucosidase alfa (25,5%) εμφάνισαν τουλάχιστον μία σχετιζόμενη με την έγχυση αντίδραση που οριζόταν στο πρωτόκολλο της μελέτης σε σύγκριση με το σκέλος θεραπείας με alglucosidase alfa (32,7%). Δεδομένα ανοσογονικότητας υπόκεινται σε ανάλυση και θα παρουσιαστούν μελλοντικά σε ιατρικό συνέδριο ήεπιστημονικό περιοδικό.
Σχεδιασμός μελέτης
Στην τυχαιοποιημένη, διπλή τυφλή, συγκριτική μελέτη Φάσης 3 COMET συμμετείχαν 100 μη προηγούμενα θεραπευόμενοι παιδιατρικοί και ενήλικες ασθενείς με νόσο Pompe όψιμης έναρξης από 56 κέντρα, σε 20 χώρες.
Οι ασθενείς τυχαιοποιήθηκαν για να λάβουν είτε avalglucosidase alfa 20 mg/kg είτε alglucosidase alfa (καθιερωμένη θεραπεία) 20 mg/kg μέσω ενδοφλέβιας έγχυσης κάθε δύο εβδομάδες για χρονικό διάστημα 49 εβδομάδων.
Μετά τις 49 εβδομάδες, οι ασθενείς που προηγουμένως λάμβαναν την καθιερωμένη θεραπεία άλλαξαν προς θεραπεία με avalglucosidase alfa 20 mg/kg για το συνεχιζόμενο τμήμα της ανοιχτής φάσης της μελέτης.i
Σχετικά με τη νόσο Pompe
Η νόσος Pompe προκαλείται από μία γενετική ανεπάρκεια ή δυσλειτουργία του λυσοσωμικού ενζύμου της όξινης άλφα-γλυκοσιδάσης (GAA), που οδηγεί στη συσσώρευση γλυκογόνου στους μύες, συμπεριλαμβανομένων των εγγύς μυών και του διαφράγματος και τελικά προξενεί προοδευτική και μη αναστρέψιμη μυϊκή βλάβη. Αυτή η σπάνια νόσος υπολογίζεται ότι επηρεάζει 50.000 ανθρώπους παγκοσμίως και είναι δυνατό να εκδηλωθεί σε κάθε ηλικία, από τη βρεφική ηλικία μέχρι και την ύστερη ενήλικη ζωή. Η νόσος Pompe συνήθως ταξινομείται ως νόσος Pompe όψιμης έναρξης (LOPD) ή βρεφική νόσος Pompe (IOPD). Οι ασθενείς με νόσο Pompe όψιμης έναρξης συνήθως εκδηλώνουν τη νόσο ανά πάσα στιγμή μετά τον πρώτο χρόνο ζωής έως και την ύστερη ενήλικη ζωή.
Τα κλασικά συμπτώματα της νόσου Pompe όψιμης έναρξης είναι μειωμένη αναπνευστική λειτουργία και αδυναμία των σκελετικών μυών, που συχνά οδηγεί σε μειωμένη κινητικότητα. Οι ασθενείς συχνά χρειάζονται αναπηρικό αμαξίδιο για υποβοήθηση της κινητικότητάς τους, ενώ ενδέχεται να έχουν ανάγκη από μηχανική υποστήριξη της αναπνοής.
Η αναπνευστική ανεπάρκεια αποτελεί την πιο συνηθισμένη αιτία θανάτου. Η νόσος Pompe ταξινομείται ως βρεφική, όταν τα συμπτώματα εμφανίζονται πριν από τον πρώτο χρόνο ζωής. Πέραν της αδυναμίας των σκελετικών μυών, είναι σύνηθες να επηρεάζεται και η καρδιακή λειτουργία.
Σχετικά με την avalglucosidase alfa
Στόχος της θεραπείας ενζυμικής υποκατάστασης στη νόσο Pompe είναι να μεταφέρει το ένζυμο στα λυσοσώματα των μυϊκών κυττάρων, ώστε να υποκαταστήσει την έλλειψη ή την ανεπάρκεια της όξινης άλφα-γλυκοσιδάσης (GAA) που απαιτείται για την αποτροπή συσσώρευσης γλυκογόνου στους μύες. Η avalglucosidase alfa αποτελεί μια ερευνητική θεραπεία ενζυμικής υποκατάστασης για τη νόσο Pompe που έχει σχεδιαστεί για να βελτιώνει τη μεταφορά του ενζύμου στα κύτταρα των μυών, κατά κύριο λόγο των σκελετικών μυών. Με σχεδόν 15πλάσια αύξηση της ποσότητας της 6-φωσφορικής μαννόζης σε σύγκριση με την καθιερωμένη θεραπεία με alglucosidase alfa, η avalglucosidase alfa στοχεύει να συμβάλει στη βελτίωση της πρόσληψης κυτταρικού ενζύμου και στην ενίσχυση της κάθαρσης του γλυκογόνου σε στοχευμένους ιστούς.ii Η κλινική συνάφεια της συγκεκριμένης διαφοράς δεν έχει τεκμηριωθεί.
Πέραν της μελέτης Φάσης 3 COMET, το πρόγραμμα κλινικής ανάπτυξης της avalglucosidase alfa περιλαμβάνει τη συνεχιζόμενη μελέτη Φάσης 2 NEO-EXTiii που αξιολογεί τη μακροχρόνια ασφάλεια, την ανεκτικότητα, τη φαρμακοκινητική, τη φαρμακοδυναμική και τη διερευνητική αποτελεσματικότητα της avalglucosidase alfa σε ασθενείς με νόσο Pompe όψιμης έναρξης για ένα χρονικό διάστημα έως και περίπου 8 ετών σε συμμετέχοντες από τη μελέτη Φάσης 1 / 2 NEO1. Επιπλέον, η συνεχιζόμενη μελέτη Φάσης 2 mini-COMETiv ερευνά την ασφάλεια και την αποτελεσματικότητα της θεραπείας με avalglucosidase alfa σε ασθενείς που πάσχουν από τη βρεφική μορφή της νόσου Pompe και λάμβαναν προηγουμένως θεραπεία με alglucosidase alfa. Για περισσότερες πληροφορίες σχετικά με το πρόγραμμα κλινικής ανάπτυξης της avalglucosidase alfa, επισκεφθείτε τον ιστότοπο https://www.clinicaltrials.gov.
Η avalglucosidase alfa δεν έχει εγκριθεί από τον Aμερικανικό Οργανισμό Τροφίμων και Φαρμάκων (FDA) ή οποιαδήποτε άλλη ρυθμιστική αρχή για τις υπό έρευνα χρήσεις.
Σχετικά με τη Sanofi
Η Sanofi έχει αφοσιωθεί στην υποστήριξη των ανθρώπων για την αντιμετώπιση των προκλήσεων υγείας.
Είμαστε μια παγκόσμια βιοφαρμακευτική εταιρεία που εστιάζει στην ανθρώπινη υγεία. Προλαμβάνουμε τις ασθένειες με εμβόλια και προσφέρουμε καινοτόμες θεραπείες οι οποίες αμβλύνουν τον πόνο και βελτιώνουν τη διαχείριση της εκάστοτε νόσου. Στεκόμαστε δίπλα τόσο στους λίγους που πάσχουν από σπάνιες παθήσεις, όσο και στα εκατομμύρια ανθρώπων που ζουν με χρόνιες παθήσεις ανά την υφήλιο. Με περισσότερους από 100.000 εργαζομένους σε 100 χώρες, η Sanofi μετατρέπει την επιστημονική καινοτομία σε λύσεις υγείας σε ολόκληρο τον κόσμο.
Sanofi, Empowering Life, Ενδυναμώνοντας τη Ζωή
www.sanofi.com
www.sanofi.gr







