Το nilotinib της Novartis λαμβάνει έγκριση από την ΕΕ
Το φάρμακο Nilotinib της Novartis λαμβάνει έγκριση από την ΕΕ να συμπεριληφθούν τα δεδομένα Ύφεσης χωρίς Θεραπευτική Αγωγή (TFR) στην ένδειξη του προϊόντος
- Το nilotinib είναι ο πρώτος και ο μοναδικός αναστολέας της τυροσινικής κινάσης (TKI) που περιλαμβάνει πληροφορίες για τη διακοπή της θεραπείας στους ασθενείς με Ph+ Χρόνια μυελογενή λευχαιμία σε χρόνια φάση στην εγκεκριμένη περίληψη χαρακτηριστικών του προϊόντος στην ΕΕ.
- Η έγκριση βασίζεται στις κλινικές δοκιμές της Novartis που αξιολογούν την TFR με το nilotinib στους ασθενείς με Ph+ ΧΜΛ χρόνιας φάσης, είτε αυτό χορηγήθηκε ως θεραπεία πρώτης γραμμής, είτε χορηγήθηκε έπειτα από αρχική αγωγή με imatinib
- Η προσθήκη των δεδομένων για την TFR στην ένδειξη, παρέχει στους ιατρούς και τους ασθενείς σημαντικές κλινικές πληροφορίες για μια δυνητική προσέγγιση στη διαχείριση της Ph+ Χρόνιας μυελογενούς λευχαιμίας σε χρόνια φάση.
Αθήνα, Ιούλιος 2017 – Η Νovartis ανακοίνωσε σήμερα ότι η Ευρωπαϊκή Επιτροπή ενέκρινε την εισαγωγή των δεδομένων Ύφεσης χωρίς Φαρμακευτική Αγωγή (TFR) στην Περίληψη Χαρακτηριστικών Προϊόντος (ΠΧΠ) του nilotinib. Η TFR είναι η δυνατότητα διατήρησης της μοριακής ανταπόκρισης (MR) μετά τη διακοπή της θεραπείας με αναστολέα της τυροσινικής κινάσης (TKI) στους ασθενείς με θετική στο χρωμόσωμα Φιλαδέλφειας (Ph+) χρόνια μυελογενή λευχαιμία (ΧΜΛ) χρόνιας φάσης (CP)1. Αυτό είναι ένα σημαντικό ορόσημο για την κοινότητα της Ph+ ΧΜΛ, καθώς το nilotinib είναι τώρα ο πρώτος και ο μοναδικός TKI που περιλαμβάνει πληροφορίες για την TFR στην ένδειξη στην Ευρωπαϊκή Ένωση (ΕΕ).
«Εδώ και περισσότερα από 15 χρόνια, η Novartis δεσμεύεται για τη βελτίωση της θεραπείας στην Ph+ ΧΜΛ», δήλωσε ο Bruno Strigini, CEO της Novartis Oncology. «Με αυτή την έγκριση από την ΕΕ, χαιρόμαστε πολύ που τα αποτελέσματα από δύο μελέτες του μεγάλου μας διεθνούς προγράμματος κλινικών δοκιμών για την Ph+ ΧΜΛ, τις ENESTfreedom και ENESTop, οι οποίες αξιολογούν τη διακοπή του nilotinib, παρέχουν σήμερα στους ιατρούς σημαντικές κλινικές πληροφορίες για τη διακοπή της θεραπείας σε ορισμένους ασθενείς».
Η έγκριση από την Ευρωπαϊκή Επιτροπή βασίστηκε στα ευρήματα αποτελεσματικότητας και ασφάλειας από τις αναλύσεις δύο δοκιμών ανοικτής επισήμανσης, διάρκειας 48 εβδομάδων των ENESTfreedom και ENESTop, οι οποίες έδειξαν ότι πάνω από το 50% των ασθενών με Ph+ ΧΜΛ χρόνιας φάσης που πληρούσαν τα αυστηρά προκαθορισμένα κριτήρια ανταπόκρισης των δοκιμών κατάφεραν να διατηρήσουν την TFR μετά τη διακοπή του nilotinib, είτε αυτό χορηγήθηκε ως θεραπεία πρώτης γραμμής, είτε χορηγήθηκε έπειτα από αρχική αγωγή με imatinib 2,3. Σε αυτές τις μελέτες, στις αναλύσεις διάρκειας 48 εβδομάδων που διενεργήθηκαν στους ασθενείς που έλαβαν αγωγή με το nilotinib, δεν παρατηρήθηκαν νέα σημαντικά ευρήματα ως προς την ασφάλεια πέραν αυτών στο γνωστό προφίλ ασφάλειας του nilotinib 2,3.
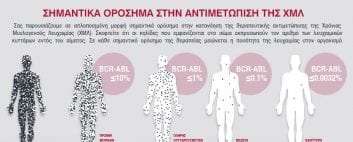
Ένα σημαντικό μέρος των δοκιμών ENESTfreedom και ENESTop ήταν η τακτική και συχνή μοριακή παρακολούθηση των επιπέδων της πρωτεΐνης BCR-ABL με μια αξιόπιστη διαδικασία, ικανή να μετρήσει τα επίπεδα μεταγραφής της BCR-ABL σε βάθος MR4,5 (Διεθνής Κλίμακα BCR-ABL1 [IS] ≤ 0,0032%). Η συχνή παρακολούθηση των ασθενών μετά τη διακοπή του nilotinib επιτρέπει τον έγκαιρο προσδιορισμό της απώλειας της MR4,0 (BCR-ABL1 IS ≤ 0.01%) και της μείζονος μοριακής ανταπόκρισης (MMR· BCR-ABL1 IS ≤ 0,1%), καθώς και της ανάγκης για επανέναρξη της θεραπείας2,3.
Σχετικά με την Ph+ ΧΜΛ
Η ΧΜΛ είναι ένας τύπος καρκίνου στον οποίο το σώμα παράγει καρκινώδη λευκά αιμοσφαίρια. Σχεδόν όλοι οι ασθενείς με ΧΜΛ διαθέτουν μια ανωμαλία που είναι γνωστή ως χρωμόσωμα Φιλαδέλφειας, η οποία παράγει μια πρωτεΐνη που ονομάζεται BCR-ABL. Η BCR-ABL προκαλεί τον πολλαπλασιασμό των κακοήθων λευκών αιμοσφαιρίων. Παγκοσμίως, η ΧΜΛ ευθύνεται για περίπου 10% έως 15% όλων των περιστατικών λευχαιμίας στους ενήλικες, με επίπτωση ενός ή δύο περιστατικών ανά 100.000 ανθρώπους κατ’ έτος4.
Η δέσμευση της Novartis για τη ΧΜΛ
Τις τελευταίες δεκαετίες, η έρευνα της Novartis στο πεδίο της Ph+ ΧΜΛ βοήθησε στο να μετατραπεί η νόσος από μια θανατηφόρα μορφή λευχαιμίας σε μια χρόνια πάθηση στους περισσότερους ασθενείς και σήμερα η εταιρεία συνεχίζει τη μακροχρόνια δέσμευσή της προς την παγκόσμια κοινότητα της ΧΜΛ. Η Novartis ακολουθεί την εξέλιξη της επιστήμης και αξιοποιεί τα υπάρχοντα στοιχεία στην προσπάθειά της να διερευνήσει τι θα μπορούσε να συμβάλλει καθοριστικά στο μέλλον στη θεραπεία της Ph+ ΧΜΛ. Η εταιρεία αξιολογεί περισσότερους από 1.000 ασθενείς στο πλαίσιο των μελετών για την TFR με το nilotinib, οι οποίες περιλαμβάνουν την ENESTfreedom και την ENESTop. Επίσης χρηματοδοτεί δύο επιπλέον τρέχουσες μελέτες για την TFR καθώς και πολλές μελέτες που προτείνονται από ερευνητές ενώ αξιολογεί υπό έρευνα ενώσεις.
Σχετικά με την ENESTfreedom
Η ENESTfreedom (Αξιολόγηση της Αποτελεσματικότητας και της Ασφαλείας της Νιλοτινίμπης σε Κλινικές Δοκιμές – Παρακολούθηση της Ανταπόκρισης σε Νεοδιαγνωσθέντες Ασθενείς με ΧΜΛ Χρόνιας Φάσης) είναι μια ανοικτής επισήμανσης μελέτη Φάσης ΙΙ που αφορά 215 ασθενείς με Ph+ ΧΜΛ χρόνιας φάσης και διεξάγεται σε 132 κέντρα σε 19 χώρες. Η δοκιμή αξιολόγησε τη διακοπή της θεραπευτικής αγωγής σε 190 ενήλικες με Ph+ ΧΜΛ χρόνιας φάσης, αφού οι ασθενείς είχαν επιτύχει ανταπόκριση MR4,5 με το nilotinib και παρατεταμένη βαθιά μοριακή ανταπόκριση διάρκειας ενός έτους ως αγωγή πρώτης γραμμής.
Τα αποτελέσματα από τη μελέτη ENESTfreedom έδειξαν ότι περισσότεροι από τους μισούς (51,6%) των 190 ασθενών με Ph+ ΧΜΛ χρόνιας φάσης στη δοκιμή (διάστημα εμπιστοσύνης [CI] 95%: 44,2%-58,9%) κατάφεραν να διακόψουν την αγωγή τους και να παραμείνουν σε κατάσταση TFR στην ανάλυση διάρκειας 48 εβδομάδων. Η ENESTfreedom δεν πέτυχε το πρωτεύον καταληκτικό της σημείο, δηλ. το ποσοστό ασθενών σε μείζονα μοριακή ανταπόκριση στις 48 εβδομάδες στη φάση της TFR, σύμφωνα με την αρχική στατιστική υπόθεση ότι το κατώτερο όριο του διαστήματος εμπιστοσύνης 95% θα ισούται με ή θα είναι μεγαλύτερο από 50%. Η διάμεση διάρκεια της θεραπείας σε αυτή τη δοκιμή ήταν 3,6 έτη.
Στην ENESTfreedom, 24,7% των ασθενών εμφάνισαν μυοσκελετικό άλγος κατά τη διάρκεια του πρώτου έτους της φάσης της TFR, έναντι ποσοστού 16,3% κατά το διάστημα που λάμβαναν ακόμη nilotinib στη φάση εδραίωσης ενός έτους. Κανένας ασθενής δεν εμφάνισε εξέλιξη στην προχωρημένη φάση/σε βλαστική κρίση στη μελέτη.
Σχετικά με την ENESTop
Η ENESTop (Δοκιμή Αξιολόγησης της Αποτελεσματικότητας και της Ασφαλείας της Νιλοτινίμπης) είναι μια ανοικτής επισήμανσης μελέτη Φάσης ΙΙ που αφορά 163 ασθενείς με Ph+ ΧΜΛ χρόνιας φάσης και διεξάγεται σε 63 κέντρα σε 18 χώρες. Η δοκιμή αξιολόγησε τη διακοπή της θεραπευτικής αγωγής σε 126 ενήλικες με Ph+ ΧΜΛ χρόνιας φάσης, αφού είχαν πετύχει και διατηρήσει βαθιά μοριακή ανταπόκριση στη διάρκεια ενός έτους θεραπείας με το nilotinib έπειτα από αγωγή με το imatinib.
Η ENESTop έδειξε ότι σχεδόν 6 στους 10 (57,9%) ασθενείς στη δοκιμή (διάστημα εμπιστοσύνης 95%: 48,8%-66,7%) διατήρησαν μοριακή ανταπόκριση στο διάστημα 48 εβδομάδων έπειτα από τη διακοπή της θεραπείας. Η μελέτη πέτυχε το πρωτεύον καταληκτικό της σημείο ως προς το ποσοστό ασθενών χωρίς επιβεβαιωμένη απώλεια MR4,0 ή MMR εντός 48 εβδομάδων από τη διακοπή της αγωγής με nilotinib στη φάση της TFR.
Στην ENESTop, τα ποσοστά μυοσκελετικού άλγους όλων των βαθμών ήταν 42,1% κατά τη διάρκεια του πρώτου έτους της φάσης της TFR, έναντι ποσοστού 14,3% κατά το διάστημα που οι ασθενείς λάμβαναν ακόμη nilotinib στη φάση εδραίωσης. Κανένας ασθενής δεν εμφάνισε εξέλιξη στην προχωρημένη φάση/σε βλαστική κρίση στη μελέτη.
Σχετικά με το nilotinib
Το nilotinib έχει λάβει έγκριση σε περισσότερες από 122 χώρες για τη θεραπεία της θετικής στο χρωμόσωμα Φιλαδέλφειας χρόνιας μυελογενούς λευχαιμίας (Ph+ ΧΜΛ) σε χρόνια ή επιταχυνόμενη φάση σε ενήλικες ασθενείς με ανθεκτικότητα ή μη ανοχή σε τουλάχιστον μία προηγούμενη θεραπεία, συμπεριλαμβανομένου του imatinib και σε περισσότερες από 110 χώρες για τη θεραπεία ενήλικων ασθενών με νεοδιαγνωσθείσα Ph+ ΧΜΛ σε χρόνια φάση.
Δήλωση αποποίησης ευθύνης
Το παραπάνω δελτίο περιέχει δηλώσεις περί μελλοντικών προοπτικών, οι οποίες μπορούν να προσδιοριστούν από τη χρήση λέξεων όπως «πιθανό», «δεσμεύεται», «δέσμευση», «αξιοποιεί», «διερευνήσει», «θα μπορούσε», «αξιολογεί», «σε εξέλιξη», «υπό έρευνα» ή παρόμοιους όρους, ή από ρητές ή έμμεσες διατυπώσεις αναφορικά με ενδεχόμενες νέες ενδείξεις ή ενδεχόμενη νέα επισήμανση του nilotinib ή του imatinib, ή σχετικά με ενδεχόμενα μελλοντικά έσοδα από το nilotinib και το imatinib. Δεν θα πρέπει να βασίζεστε υπέρ το δέον σε αυτές τις δηλώσεις. Αυτού του τύπου οι δηλώσεις περί μελλοντικών προοπτικών βασίζονται στις τρέχουσες πεποιθήσεις και προσδοκίες της διοίκησης αναφορικά με μελλοντικά συμβάντα και υπόκεινται σε σημαντικούς γνωστούς και άγνωστους κινδύνους και αβεβαιότητες. Σε περίπτωση που επαληθευτούν ένας ή περισσότεροι από αυτούς τους κινδύνους ή τις αβεβαιότητες ή σε περίπτωση που αποδειχθούν εσφαλμένες οι υποκείμενες παραδοχές, τα πραγματικά αποτελέσματα ενδέχεται να διαφέρουν ουσιαστικά από αυτά που αναφέρονται στις δηλώσεις περί μελλοντικών προοπτικών. Δεν μπορεί να υπάρξει καμία εγγύηση ότι το nilotinib ή το imatinib θα υποβληθούν προς έγκριση ή θα λάβουν έγκριση για τυχόν επιπρόσθετες ενδείξεις ή επισήμανση σε οποιαδήποτε αγορά ή σε οποιαδήποτε συγκεκριμένη χρονική στιγμή. Ούτε μπορεί να υπάρξει καμία εγγύηση ότι το nilotinib ή το imatinib θα είναι εμπορικά επιτυχή στο μέλλον. Συγκεκριμένα, οι προσδοκίες της διοίκησης σχετικά με το nilotinib και το imatinib θα μπορούσαν να επηρεαστούν, μεταξύ άλλων, από εγγενείς αβεβαιότητες της έρευνας και της ανάπτυξης, όπως τα αποτελέσματα κλινικών δοκιμών και η πρόσθετη ανάλυση των υφιστάμενων κλινικών δεδομένων, οι ενέργειες ή οι καθυστερήσεις εκ μέρους των ρυθμιστικών αρχών ή οι κυβερνητικές ρυθμίσεις εν γένει, η δυνατότητα της εταιρείας να αποκτήσει ή να διατηρήσει την προστασία των δικαιωμάτων πνευματικής ιδιοκτησίας της, οι γενικότερες οικονομικές και βιομηχανικές συνθήκες, οι διεθνείς τάσεις όσον αφορά τη συγκράτηση των δαπανών στον χώρο της υγείας, συμπεριλαμβανομένων των συνεχών πιέσεων για μείωση των τιμών και αποζημίωση, τα ζητήματα ασφάλειας, ποιότητας ή κατασκευής, καθώς και κάθε άλλοι κίνδυνοι και παράγοντες που αναφέρονται στο τρέχον έντυπο Form 20-F της Novartis AG που έχει κατατεθεί στην Επιτροπή Κεφαλαιαγοράς των ΗΠΑ. Η Novartis παρέχει τις πληροφορίες που περιέχονται στο παρόν δελτίο τύπου ως έχουν σήμερα και δεν αναλαμβάνει καμία υποχρέωση να επικαιροποιήσει τις δηλώσεις περί μελλοντικών εξελίξεων που περιέχονται στο παρόν δελτίο ως αποτέλεσμα νέων πληροφοριών, μελλοντικών συμβάντων ή για οποιονδήποτε άλλο λόγο.
Σχετικά με τη Novartis
Η Novartis παρέχει καινοτόμες λύσεις υγείας που ικανοποιούν τις εξελισσόμενες ανάγκες των ασθενών και των κοινωνιών. Η Novartis εδρεύει στη Βασιλεία της Ελβετίας και προσφέρει ένα διαφοροποιημένο χαρτοφυλάκιο για την καλύτερη δυνατή κάλυψη των αναγκών αυτών: καινοτόμα φάρμακα, οφθαλμιατρικά προϊόντα και οικονομικά γενόσημα. Η Novartis είναι η μόνη πολυεθνική εταιρεία που κατέχει ηγετική θέση σε αυτούς τους τομείς. Το 2016, ο Όμιλος σημείωσε καθαρές πωλήσεις ύψους 48,5 δις δολαρίων ΗΠΑ, ενώ οι δαπάνες Έρευνας και Ανάπτυξης σε ολόκληρο τον Όμιλο ανήλθαν σε περίπου 9 δις δολάρια ΗΠΑ. Οι εταιρείες του Ομίλου Novartis απασχολούν περίπου 118.000 συνεργάτες πλήρους απασχόλησης. Τα προϊόντα της Novartis είναι διαθέσιμα σε περίπου 155 χώρες σε όλο τον κόσμο.
Για περισσότερες πληροφορίες, επισκεφθείτε τις διαδικτυακές διευθύνσεις:
Η Novartis στo Facebook:
@NovartisHellas
Η Novartis στο Twitter.
Παραπομπές
- Hughes, T.P. and Ross, D.M. Moving treatment-free remission into mainstream clinical practice in CML. Blood. 2016. Advance online publication. doi# 10.1182/blood-2016-01-694265.
- Hochhaus, A. et al. Treatment-free remission following frontline nilotinib in patients with chronic myeloid leukemia in chronic phase: results from the ENESTfreedom study. Leukemia. 17 March 2017. Advance online publication. doi# 10.1038/leu.2017.63.
- Hughes, T.P. et al. Treatment-free remission (TFR) in patients (pts) with chronic myeloid leukemia in chronic phase (CML-CP) treated with second-line nilotinib (NIL): First results from the ENESTop study. Poster Presentation. Abstract #7054. 2016 American Society of Clinical Oncology (ASCO) Annual Meeting in Chicago, IL, USA.
- Central European Leukemia Study Group. About CML. 2007. Available at: http://www.cml-info.com/de/healthcare-professionals/about-cml.html. Accessed March 2017.
ΣΗΜΑΝΤΙΚΑ ΟΡΟΣΗΜΑ ΣΤΗΝ ΑΝΤΙΜΕΤΩΠΙΣΗ ΤΗΣ ΧΜΛ