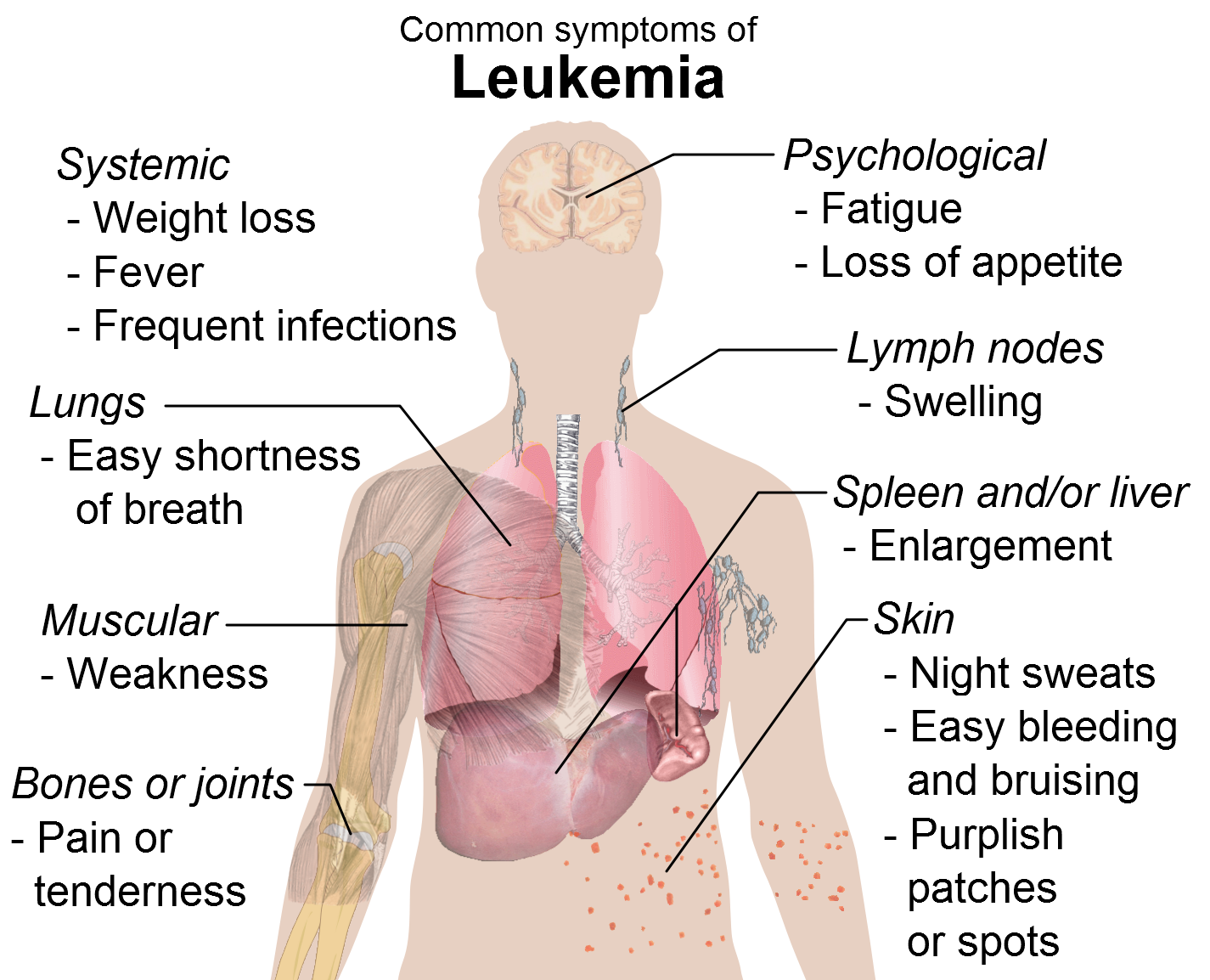
Το venetoclax έλαβε θετική γνωμοδότηση από την CHMP του Ευρωπαϊκού Οργανισμού Φαρμάκων για ασθενείς με Χρόνια Λεμφοκυτταρική Λευχαιμία

Η βιοφαρμακευτική εταιρεία AbbVie ανακοίνωσε πρόσφατα ότι το venetoclax έλαβε θετική γνωμοδότηση από την Επιτροπή για τα Φαρμακευτικά Προϊόντα Ανθρώπινης Χρήσης (CHMP) του Ευρωπαϊκού Οργανισμού Φαρμάκων (ΕΜΑ).
Το venetoclax ως μονοθεραπεία ενδείκνυται για τη θεραπεία της χρόνιας λεμφοκυτταρικής λευχαιμίας (ΧΛΛ) παρουσία έλλειψης 17p ή μετάλλαξης στο ΤΡ53 σε ενήλικους ασθενείς, οι οποίοι δεν είναι κατάλληλοι ή έχουν αποτύχει σε θεραπεία με έναν αναστολέα του μονοπατιού του υποδοχέα των Β-λεμφοκυττάρων. Επίσης, ως μονοθεραπεία ενδείκνυται για τη θεραπεία της ΧΛΛ απουσία έλλειψης 17p ή μετάλλαξης στο ΤΡ53 σε ενήλικους ασθενείς, οι οποίοι έχουν αποτύχει τόσο σε ανοσοχημειοθεραπεία, όσο και σε θεραπεία με έναν αναστολέα του μονοπατιού του υποδοχέα των Β-λεμφοκυττάρων.
«Οι ασθενείς με ΧΛΛ που είτε δεν ανταποκρίθηκαν σε άλλες θεραπείες είτε έχουν έλλειψη στο χρωμόσωμα 17p ή μετάλλαξη του TP53 έχουν περιορισμένες θεραπευτικές επιλογές και συνήθως δυσμενή πρόγνωση. Η θετική γνωμοδότηση της CHMP σηματοδοτεί μια σπουδαία εξέλιξη για αυτούς τους ασθενείς», δήλωσε ο Michael Severino, M.D., Εxecutive Vice President R&D, Chief Scientific Officer της AbbVie. «Η καινοτομία αυτή ανταποκρίνεται στη δέσμευση που έχει αναλάβει η AbbVie για την ανάπτυξη αντικαρκινικών φαρμάκων, που στοχεύουν στην κάλυψη των αναγκών ασθενών για τους οποίους δεν υπάρχει αυτή τη στιγμή θεραπεία. Θα συνεχίσουμε να συνεργαζόμαστε με τις ευρωπαϊκές ρυθμιστικές αρχές ώστε να μπορέσουμε να διαθέσουμε το venetoclax στους κατάλληλους ασθενείς με ΧΛΛ.»
Η ΧΛΛ είναι, κατά κανόνα, ένας βραδείας εξέλιξης καρκίνος του μυελού των οστών και του αίματος. Η έλλειψη του 17p, μια γονιδιακή αλλοίωση, κατά την οποία ένα τμήμα του χρωμοσώματος 17 απουσιάζει, εμφανίζεται στο 3-10% των ασθενών με ΧΛΛ που δεν έχουν λάβει θεραπεία στο παρελθόν και έως στο 30-50% των ασθενών με υποτροπιάζουσα ή ανθεκτική ΧΛΛ.1 Η μετάλλαξη του γονιδίου TP53 αφορά στο 8-15% των ασθενών σε θεραπεία πρώτης γραμμής και έως στο 35-50% των ασθενών με ανθεκτική ΧΛΛ.1 Η πρόγνωση για τους ασθενείς με έλλειψη 17p ή μετάλλαξη TP53 συχνά είναι ιδιαίτερα δυσμενής1 ενώ το διάμεσο προσδόκιμο επιβίωσης είναι λιγότερο από 2-3 έτη, με τις παρούσες θεραπευτικές αγωγές αναφοράς.2
Η θετική γνωμοδότηση της CHMP για το venetoclax αποτελεί μια επιστημονική σύσταση προς την Ευρωπαϊκή Επιτροπή για την υπό όρους χορήγηση άδειας κυκλοφορίας. Η Ευρωπαϊκή Επιτροπή θα αξιολογήσει τη θετική γνωμοδότηση της CHMP και με την οριστική απόφαση της, η οποία αναμένεται να εκδοθεί σύντομα, το venetoclax θα αποτελεί τον πρώτο εγκεκριμένο αναστολέα της πρωτεΐνης BCL-2 για τη θεραπεία της ΧΛΛ.Ο EMA χορηγεί άδεια κυκλοφορίας υπό όρους σε φάρμακα, όταν τα οφέλη για τη δημόσια υγεία από την άμεση διάθεσή τους στους ασθενείς υπερτερούν του κινδύνου που απορρέει από την ανάγκη συλλογής συμπληρωματικών δεδομένων.
—————————————————————————————————————-
Σχετικά με τον χαρακτηρισμό του venetoclax ως ορφανού φαρμάκου
Πρόσφατα, η Επιτροπή για τα Ορφανά Φάρμακα (COMP) του EMA εξέδωσε θετική γνωμοδότηση για το χαρακτηρισμό του venetoclax ως ορφανού φαρμάκου για τη θεραπεία του πολλαπλού μυελώματος, ένα είδος καρκίνου που αναπτύσσεται από τα πλασμοκύτταρα στο μυελό των οστών3 και του διάχυτου λεμφώματος από μεγάλα Β-κυτταρα (DLBCL), ένα επιθετικό είδος λεμφώματος που αποτελεί την πιο συχνή μορφή μη-Hodgkin λεμφώματος (NHL).4 Προηγουμένως, ο EMA είχε εγκρίνει το χαρακτηρισμό του venetoclax ως ορφανού φαρμάκου για τη θεραπεία της ΧΛΛ και της οξείας μυελογενούς λευχαιμίας (ΟΜΛ) που αποτελεί τη συχνότερη μορφή οξείας λευχαιμίας στους ενήλικες.5
Ο χαρακτηρισμός «Ορφανό Φάρμακο» χορηγείται σε θεραπείες που στοχεύουν τη θεραπεία, την πρόληψη ή τη διάγνωση επικίνδυνων για τη ζωή παθήσεων, που προσβάλλουν όχι περισσότερα από πέντε άτομα ανά 10.000 στην Ευρωπαϊκή Ένωση και για τις οποίες δεν υπάρχει ικανοποιητική θεραπεία. Η θεραπεία αυτή θα πρέπει επίσης να παρέχει σημαντικό όφελος στους ασθενείς. 6
Σχετικά με το venetoclax
Το venetoclax είναι ένας υπό έρευνα από του στόματος αναστολέας της πρωτεΐνης BCL-2 που μελετάται για τη θεραπεία ασθενών με διάφορα είδη κακοήθων νεοπλασιών του αίματος.7,8,9,10 Η πρωτεΐνη BCL-2 αποτρέπει την απόπτωση ορισμένων κυττάρων (προγραμματισμένος κυτταρικός θάνατος), συμπεριλαμβανομένων των λεμφοκυττάρων, και μπορεί να υπερεκφράζεται σε ορισμένα κακοήθη νεοπλασματικά κύτταρα. Το venetoclax, το οποίο χορηγείται άπαξ ημερησίως, είναι σχεδιασμένο να αναστέλλει επιλεκτικά τη λειτουργία της πρωτεΐνης BCL-2.11
Το venetoclax αναπτύσσεται από την AbbVie και την Genentech, μέλος του Roche Group. Στις ΗΠΑ διατίθεται και από τις δύο εταιρείες, ενώ σε όλες τις υπόλοιπες χώρες διατίθεται από την AbbVie. Οι εταιρείες έχουν αφοσιωθεί από κοινού στην έρευνα της BCL-2 με το venetoclax, το οποίο αξιολογείται επί του παρόντος σε κλινικές μελέτες φάσης 3 για τη θεραπεία της υποτροπιάζουσας/ανθεκτικής ΧΛΛ, μαζί με μελέτες πρώιμης φάσης για πολλές άλλες μορφές καρκίνου.
Τον Απρίλιο του 2016, ο Οργανισμός Τροφίμων και Φαρμάκων των ΗΠΑ (FDA) ενέκρινε μέσω διαδικασίας ταχείας αξιολόγησης το venetoclax, σε μορφή δισκίων, για τη θεραπεία ασθενών με χρόνια λεμφοκυτταρική λευχαιμία (ΧΛΛ) με έλλειψη στο χρωμόσωμα 17p, όπως αυτή ανιχνεύεται με εγκεκριμένο από τον FDA τεστ και οι οποίοι έχουν λάβει τουλάχιστον μία θεραπεία στο παρελθόν.7 Ο FDA ενέκρινε τη συγκεκριμένη ένδειξη βάσει του συνολικού ποσοστού ανταπόκρισης, ενώ η διατήρηση της έγκρισης ενδέχεται να εξαρτηθεί από την επαλήθευση και την περιγραφή του κλινικού οφέλους στο πλαίσιο μελέτης επιβεβαίωσης7.
Σχετικά με το τμήμα Αιματολογίας – Ογκολογίας της AbbVie
Η αντιμετώπιση των μεγαλύτερων προκλήσεων στον τομέα της Αιματολογίας και της Ογκολογίας μας αφορά όλους. Για το λόγο αυτό, στη βιοφαρμακευτική εταιρεία AbbVie συνεργαζόμαστε καθημερινά με ακαδημαϊκούς, κλινικούς ιατρούς, ερευνητές και άλλους επιστημονικούς εταίρους. Στόχος μας είναι να ανακαλύψουμε και να αναπτύξουμε θεραπείες ικανές να προσφέρουν ουσιαστικές λύσεις στην αντιμετώπιση των αιματολογικών κακοηθειών και των συμπαγών όγκων, προσφέροντας αξιοσημείωτη βελτίωση στις ζωές των ασθενών με καρκίνο ανά το κόσμο.
Μέσω της έρευνας και της επένδυσης σε νέους μοριακούς στόχους, νέες τεχνολογίες και προσεγγίσεις, η AbbVie βάζει τα θεμέλια για τη θεραπεία μερικών από τους πιο συχνούς και δύσκολα θεραπεύσιμους καρκίνους. Με την εξαγορά της Pharmacyclics το 2015 και της Stemcentrx το 2016, καθώς και πολλές άλλες συνεργασίες, η θεραπευτική φαρέτρα της AbbVie στην αιματολογία και την ογκολογία αποτελείται από ήδη εγκεκριμένες θεραπείες και από υπό ανάπτυξη μόρια, τα οποία αξιολογούνται στο πλαίσιο 200 κλινικών μελετών παγκοσμίως, για περισσότερους από 20 διαφορετικούς τύπους όγκων. Για περισσότερες πληροφορίες παρακαλούμε επισκεφθείτε το abbvieoncology.com.
Σχετικά με την AbbVie
Η AbbVie είναι μία παγκόσμια βιοφαρμακευτική εταιρεία, η οποία δημιουργήθηκε το 2013 μετά από το διαχωρισμό της από την Abbott Laboratories. Αποστολή της εταιρείας είναι να αξιοποιήσει την εμπειρία της, τους αφοσιωμένους ανθρώπους της και τη μοναδική προσέγγισή της για καινοτομία, με σκοπό την ανάπτυξη προηγμένων θεραπειών που θα καλύπτουν μερικές από τις πιο σύνθετες και σοβαρές ασθένειες του κόσμου. Μετά και την εξαγορά της Pharmacyclics, η AbbVie σε παγκόσμιο επίπεδο απασχολεί πλέον περίπου 28.000 εργαζομένους (115 εκ των οποίων στην Ελλάδα) και δραστηριοποιείται σε περισσότερες από 170 χώρες. Για επιπλέον πληροφορίες παρακαλούμε επισκεφθείτε το www.abbvie.gr
Παραπομπές:
- Schnaiter A, et al. 17p deletion in chronic lymphocytic leukemia: risk stratification and therapeutic approach. Hematol Oncol Clin N Am. 2013; 27:289-301.
- Stilgenbauer S, et al. Understanding and managing ultra high-risk chronic lymphocytic leukemia. Hematology Am Soc Hematol Educ Program. 2010; 1:481-488.
- Multiple Myeloma Research Foundation. Learn the basics about multiple myeloma. https://www.themmrf.org/multiple-myeloma/. Accessed October 2016.
- Lymphoma Research Foundation. Diffuse Large B-Cell Lymphoma (DLBCL). http://www.lymphoma.org/site/pp.asp?c=bkLTKaOQLmK8E&b=6300153. Accessed October 2016.
- National Cancer Institute. Adult Acute Myeloid Leukemia Treatment (PDQ®)—Patient Version. Accessed October 2016. https://www.cancer.gov/types/leukemia/patient/adult-aml-treatment-pdq.
- European Medicines Agency (2015). “Orphan Designation.” http://www.ema.europa.eu/ema/index.jsp?curl=pages/regulation/general/general_content_000029.jsp. Accessed October 2016.
- gov. NCT01889186: A study of the efficacy of ABT-199 in subjects with relapsed or refractory chronic lymphocytic leukemia with the 17p deletion. Accessed August 2016.
- gov. NCT01994837: A Phase 2 Study of ABT-199 in subjects with Acute Myelogenous Leukemia (AML). Accessed August 2016.
- gov. NCT01794520: Study evaluating ABT-199 in subjects with relapsed or refractory Multiple Myeloma. Accessed August 2016.
- gov. NCT01328626: A Phase 1 study evaluating the safety and pharmacokinetics of ABT-199 in subjects with relapsed or refractory Chronic Lymphocytic Leukemia and Non-Hodgkin Lymphoma. Accessed August 2016.
- Davids M.S. and Letai A. ABT-199: A new hope for selective BCL-2 inhibition. Cancer Cell. 2013; 23(2): 139-141.