Η Μονοθεραπεία με δαρατουμουμάμπη της Janssen εγκρίθηκε από την Ευρωπαϊκή Επιτροπή για τη Θεραπεία του Πολλαπλού Μυελώματος (ΠΜ)

Η πρώτη στην κατηγορία της ενεργή ανοσοθεραπεία που στοχεύει την CD38 παρέχει νέα θεραπευτική επιλογή στους ασθενείς με ΠΜ που έχουν εξαντλήσει τις άλλες εγκεκριμένες θεραπευτικές επιλογές
Η Janssen-Cilag International NV (“Janssen”) ανακοίνωσε ότι η Ευρωπαϊκή Επιτροπή χορήγησε την υπό όρους έγκριση για τη δαρατουμουμάμπη, για την μονοθεραπεία ενήλικων ασθενών με υποτροπιάζον και ανθεκτικό πολλαπλό μυέλωμα (ΠΜ), των οποίων η προηγούμενη θεραπεία περιλάμβανε αναστολέα πρωτεασώματος (PI) και ανοσοτροποποιητική ουσία και οι οποίοι εμφάνισαν εξέλιξη της νόσου κατά την τελευταία θεραπεία. Η δαρατουμουμάμπη εγκρίθηκε με ταχεία διαδικασία αξιολόγησης, μια διαδικασία που χρησιμοποιείται αποκλειστικά για φαρμακευτικά προϊόντα που αναμένεται να έχουν μείζον ενδιαφέρον για την δημόσια υγεία, ιδίως από την άποψη της θεραπευτικής καινοτομίας.1
Η δαρατουμουμάμπη είναι το πρώτο μονοκλωνικό αντίσωμα (mAb) με στόχο την CD38 που εγκρίνεται στην Ευρώπη. Το φάρμακο δρα μέσω σύνδεσης με την CD38, ένα μόριο σηματοδότησης με υψηλή έκφραση στην επιφάνεια των κυττάρων του πολλαπλού μυελώματος ανεξάρτητα από το στάδιο της νόσου.2-4 Με αυτό τον τρόπο, η δαρατουμουμάμπη κινητοποιεί το ανοσιακό σύστημα του ασθενούς σε επίθεση κατά των καρκινικών κυττάρων, με αποτέλεσμα τον γρήγορο θάνατο των καρκινικών κυττάρων μέσω πολλαπλών, ανοσοδιαμεσολαβούμενων μηχανισμών δράσης και μέσω ανοσοτροποποιητικών επιδράσεων, σε συνδυασμό με τον άμεσο θάνατο των καρκινικών κυττάρων μέσω απόπτωσης (προγραμματισμένος κυτταρικός θάνατος).5-9
Ο Καθηγητής Χεσούς Σαν Μιγκέλ, Διευθυντής Κλινικής & Μεταγραφικής Ιατρικής, Πανεπιστήμιο της Ναβάρα, Ισπανία, δήλωσε: “Παρά τα πρόσφατα επιτεύγματα, το πολλαπλό μυέλωμα παραμένει μια σύνθετη, ανίατη νόσος, ενώ η υποτροπή εξακολουθεί να είναι αναπόφευκτη σχεδόν σε όλους τους ασθενείς. Με κάθε υποτροπή, η νόσος συνήθως γίνεται πιο επιθετική και η αντιμετώπισή της πιο δύσκολη. Η δαρατουμουμάμπη έχει παρουσιάσει υποσχόμενα αποτελέσματα όσον αφορά την αποτελεσματικότητα και διαχειρίσιμο προφίλ ασφάλειας ως μονοθεραπεία για ασθενείς που έχουν λάβει εντατική προηγούμενη θεραπεία και για ασθενείς με ανθεκτικό μυέλωμα. Η συνολική επιβίωση βελτιώθηκε σημαντικά σε αυτούς τους ασθενείς, των οποίων η πρόγνωση συνήθως είναι πολύ κακή και οι οποίοι κατά συνέπεια έχουν τη μεγαλύτερη ανάγκη για νέες θεραπείες.”
Η έγκριση της δαρατουμουμάμπης βασίστηκε σε δεδομένα από την μελέτη Φάσης 2 MMY2002 (SIRIUS), δημοσιευμένα στο The Lancet, την μελέτη Φάσης 1/2 GEN501, δημοσιευμένα στο The New England Journal of Medicine,10,11 καθώς και σε δεδομένα από τρεις πρόσθετες υποστηρικτικές μελέτες. Τα ευρήματα από μια συνδυασμένη ανάλυση αποτελεσματικότητας των μελετών GEN501 και MMY2002 (SIRIUS) έδειξαν ότι μετά από μέση παρακολούθηση 14,8 μηνών, η εκτιμώμενη διάμεση συνολική επιβίωση (OS) για την μονοθεραπεία με δαρατουμουμάμπη (16 mg/kg) σε αυτούς τους ασθενείς που είχαν λάβει εντατική προηγούμενη θεραπεία ήταν 20 μήνες (95% CI, 15-μη σημαντικό). Tο συνολικό ποσοστό ανταπόκρισης (ORR) για την συνδυασμένη ανάλυση ήταν 31%, ενώ 83% των ασθενών πέτυχαν σταθεροποίηση της νόσου ή καλύτερο αποτέλεσμα.12 Η δαρατουμουμάμπη εμφάνισε ανεκτό και κλινικά διαχειρίσιμο προφίλ ασφάλειας ως μονοθεραπεία σε ασθενείς που είχαν λάβει εντατική προηγούμενη θεραπεία.10,11 Τα πιο συχνά ανεπιθύμητα συμβάντα (ΑΣ) στη μελέτη Φάσης 2 MMY2002 (SIRIUS), που εκδηλώθηκαν σε ποσοστό άνω του 20% των ασθενών, ήταν κόπωση, αναιμία, ναυτία, θρομβοπενία, ραχιαλγία, ουδετεροπενία και βήχας.10 Τα πιο συχνά ανεπιθύμητα συμβάντα (ΑΣ) στη μελέτη Φάσης 1/2 GEN501 ήταν κόπωση, αλλεργική ρινίτιδα και πυρεξία (πυρετός).11
Ο Σάρπερ Ντιλέρ, MD, PhD, Πρόεδρος του Οργανισμού Ασθενείς με Μυέλωμα Ευρώπης, δήλωσε: “Η σημερινή απόφαση για τη δαρατουμουμάμπη είναι εξαιρετικά νέο για τους ασθενείς καθώς θα συμβάλει στην αντιμετώπιση ενός σημαντικού τομέα ανεκπλήρωτων αναγκών όσον αφορά τα άτομα με υποτροπιάζον ή ανθεκτικό μυέλωμα. Ωστόσο, χρειάζεται να γίνει ακόμα πολλή δουλειά για την εξασφάλιση της διαθεσιμότητας της δαρατουμουμάμπης για τους ασθενείς από τα συστήματα υγείας σε όλη την Ευρώπη.”
Η Τζέιν Γκρίφφιθς, Επικεφαλής του Ομίλου Εταιρειών της Janssen Ευρώπης, Μέσης Ανατολής και Αφρικής, δήλωσε: “Η έγκριση της δαρατουμουμάμπης εντός εσπευσμένου χρονικού πλαισίου είναι απόρροια της επείγουσας εργασίας εστιασμένης στους ασθενείς, ισχυρών συνεργασιών, με αποτέλεσμα την αντιμετώπιση των ανεκπλήρωτων αναγκών μέσω της μεταμορφωτική επιστήμη. Είμαστε ιδιαιτέρως ικανοποιημένοι που η δαρατουμουμάμπη εγκρίθηκε στην Ευρώπη και θα συνεχίσουμε να μελετάμε τις δυνατότητές της στο θεραπευτικό συνεχές για το πολλαπλό μυέλωμα και άλλους τύπους όγκων.”
Η έγκριση της άδειας κυκλοφορίας ακολουθεί τη θετική γνωμοδότηση από την Ευρωπαϊκή Επιτροπή Φαρμακευτικών Προϊόντων για Ανθρώπινη Χρήση (CHMP) του Ευρωπαϊκού Οργανισμού Φαρμάκων (EMA) που ανακοινώθηκε την 01 Απριλίου 2016.13 Αυτή η έγκριση επιτρέπει την κυκλοφορία στην αγορά της δαρατουμουμάμπης στα 28 κράτη μέλη και στις τρεις χώρες του Ευρωπαϊκού Οικονομικού Χώρου της Ευρωπαϊκής Ένωσης.
Η Janssen έχει τα αποκλειστικά δικαιώματα σε παγκόσμιο επίπεδο ως προς την ανάπτυξη, την παραγωγή και την εμπορική κυκλοφορία της δαρατουμουμάμπης. Η Janssen έλαβε την άδεια της δαρατουμουμάμπης από την Genmab A/S τον Αύγουστο του 2012.
Σχετικά με το Πολλαπλό Μυέλωμα
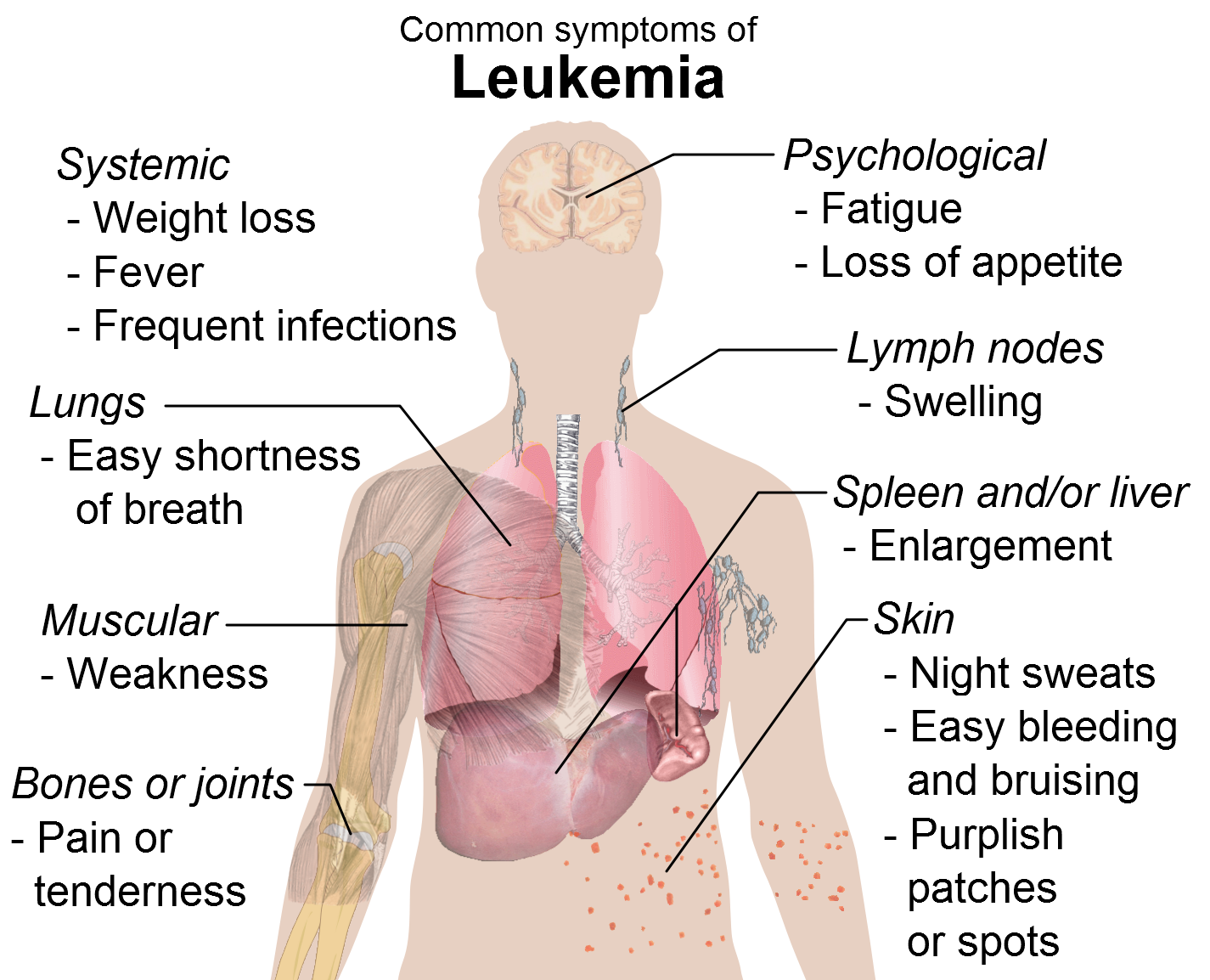
Το πολλαπλό μυέλωμα (ΠΜ) είναι ένας ανίατος καρκίνος του αίματος που ξεκινά από τον μυελό των οστών και χαρακτηρίζεται από υπερβολικό πολλαπλασιασμό των πλασματοκυττάρων.14 Το ΠM είναι η δεύτερη σε συχνότητα μορφή καρκίνου του αίματος, με περίπου 39.000 νέες περιπτώσεις παγκοσμίως το 2012.15 Το ΠM στην πλειονότητα των περιπτώσεων προσβάλλει άτομα ηλικίας άνω των 65 ετών και είναι πιο συχνό στους άνδρες σε σύγκριση με τις γυναίκες.16 Τα πιο πρόσφατα ποσοστά πενταετούς επιβίωσης για τα έτη 2000-2007 δείχνουν ότι σε όλη την Ευρώπη μέχρι και οι μισοί ασθενείς με πρόσφατη διάγνωση δεν φτάνουν την πενταετή επιβίωση.17 Σχεδόν 29% των ασθενών με ΠΜ θα πεθάνουν εντός ενός έτους από την διάγνωση.18 Aν και η θεραπεία μπορεί να οδηγήσει σε ύφεση, δυστυχώς οι ασθενείς κατά πάσα πιθανότητα θα υποτροπιάσουν, καθώς προς το παρόν δεν υπάρχει ριζική θεραπεία. Ενώ μερικοί ασθενείς με ΠΜ δεν έχουν συμπτώματα, στους περισσότερους ασθενείς η διάγνωση οφείλεται στα συμπτώματα που είναι δυνατόν να περιλαμβάνουν προβλήματα των οστών, μειωμένους αριθμούς κυττάρων του αίματος, αύξηση του ασβεστίου, προβλήματα των νεφρών ή λοιμώξεις.14 Οι ασθενείς που υποτροπιάζουν μετά την θεραπευτική αντιμετώπιση με τις καθιερωμένες θεραπείες, όπως οι αναστολείς πρωτεασώματος (ΡΙ) και οι ανοσοτροποποιητικοί παράγοντες, έχουν κακή πρόγνωση και λίγες διαθέσιμες θεραπευτικές επιλογές.19
Σχετικά με την Δαρατουμουμάμπη
Η δαρατουμουμάμπη είναι ένα πρώτο στην κατηγορία του βιολογικό φάρμακο που στοχεύει την CD38, μια επιφανειακή πρωτεΐνη με υψηλή έκφραση σε όλα τα κύτταρα του πολλαπλού μυελώματος, ανεξάρτητα από το στάδιο της νόσου.2-4 Η δαρατουμουμάμπη προκαλεί τον ταχύ θάνατο των νεοπλασματικών κυττάρων μέσω της απόπτωσης (προγραμματισμένος κυτταρικός θάνατος)6,7 και μέσω πολλαπλών ανοσιακά διαμεσολαβούμενων μηχανισμών δράσης, όπως η εξαρτώμενη από συμπλήρωμα κυτταροτοξικότητα (CDC), η εξαρτώμενη από αντίσωμα κυτταροδιαμεσολαβούμενη κυτταροτοξικότητα (ADCC) και η εξαρτώμενη από αντίσωμα κυτταροδιαμεσολαβούμενη φαγοκυττάρωση (ADCP).5,6,8 Η δαρατουμουμάμπη έχει επίσης επιδείξει δράσεις τροποποίησης της ανοσίας που συμβάλλουν στον θάνατο των νεοπλασματικών κυττάρων μέσω μείωσης των ανοσιακών κατασταλτικών κυττάρων, όπως τα ρυθμιστικά κύτταρα T, τα ρυθμιστικά κύτταρα B και τα προερχόμενα από μυελοειδή κατασταλτικά κύτταρα.9 Πέντε κλινικές μελέτες Φάσης 3 με την δαρατουμουμάμπη σε συνθήκες υποτροπής και πρώτης γραμμής βρίσκονται επί του παρόντος σε εξέλιξη. Επιπλέον μελέτες βρίσκονται σε εξέλιξη ή σχεδιάζονται για την αξιολόγηση των δυνατοτήτων του φαρμάκου σε άλλες κακοήθειες και προκακοήθεις νόσους στις οποίες εκφράζεται η CD38. Για περισσότερες πληροφορίες, παρακαλείσθε να επισκεφθείτε την διεύθυνση www.clinicaltrials.gov.
Σχετικά με τις μελέτες MMY2002 (SIRIUS) και GEN501
Αυτές οι μελέτες περιλάμβαναν ασθενείς οι οποίοι είχαν υποβληθεί σε εντατική προηγούμενη θεραπεία για υποτροπιάζον και ανθεκτικό πολλαπλό μυέλωμα, είχαν εξαντλήσει τις άλλες εγκεκριμένες θεραπευτικές επιλογές και η νόσος τους ήταν εξελισσόμενη κατά την ένταξή τους στην μελέτη. Τα δεδομένα ασφάλειας από τις μελέτες MMY2002 (SIRIUS) και GEN501 παρείχαν ενδείξεις ότι η δαρατουμουμάμπη (16 mg/kg) έχει ευνοϊκό και κλινικά διαχειρίσιμο προφίλ ασφάλειας ως μονοθεραπεία.10,11
Τα πιο συχνά ανεπιθύμητα συμβάντα (ΑΣ) στη μελέτη Φάσης 2 MMY2002 (SIRIUS), που εκδηλώθηκαν σε ποσοστό άνω του 20% των ασθενών, ήταν κόπωση (40%), αναιμία (33%), ναυτία (29%), θρομβοπενία (25%), ραχιαλγία (22%), ουδετεροπενία (23%) και βήχας (21%).10 Τα πιο συχνά ανεπιθύμητα συμβάντα (ΑΣ) στο μέρος 2 της μελέτης Φάσης 1/2 GEN501 ήταν κόπωση, αλλεργική ρινίτιδα και πυρεξία (πυρετός).11 Tα πιο συχνά αιματολογικά ΑΣ ήταν ουδετεροπενία (παθολογικά μειωμένος αριθμός ουδετερόφιλων, μια κατηγορία λευκών αιμοσφαιρίων), που σημειώθηκε στο 12% των ασθενών (n=5) στην ομάδα των 16 mg/kg.11
Σχετικά με τις Φαρμακευτικές Εταιρείες Janssen
Στις Φαρμακευτικές Εταιρείες Janssen της Johnson & Johnson, εργαζόμαστε ώστε να δημιουργήσουμε έναν κόσμο χωρίς ασθένειες. Μας εμπνέει το να μεταμορφώνουμε ζωές μέσω της εύρεσης νέων και καλύτερων τρόπων πρόληψης, παρεμπόδισης, αντιμετώπισης και θεραπείας νόσων. Συγκεντρώνουμε τους πιο λαμπρούς επιστήμονες και ακολουθούμε τα πιο υποσχόμενα επιστημονικά δεδομένα. Είμαστε η Janssen. Συνεργαζόμαστε με τον κόσμο για την υγεία όλων. Μάθετε περισσότερα στο www.janssen.com. Ακολουθήστε μας στο www.twitter.com/janssenEMEA.
Η Janssen στην Ογκολογία
Ο στόχος μας είναι να επιτύχουμε ουσιαστική μεταβολή του τρόπου κατανόησης, διάγνωσης και αντιμετώπισης του καρκίνου, ενισχύοντας την δέσμευσή μας προς τους ασθενείς που μας εμπνέουν. Κατά την προσπάθεια εξεύρεσης καινοτόμων τρόπων αντιμετώπισης της πρόκλησης που αποτελεί ο καρκίνος, οι πρωταρχικές προσπάθειές μας επικεντρώνονται σε αρκετές λύσεις θεραπείας και πρόληψης. Σε αυτές τις προσπάθειες περιλαμβάνονται: η επικέντρωση σε αιματολογικές κακοήθειες, στον καρκίνο του προστάτη και στον καρκίνο του πνεύμονα, η αναχαίτιση του καρκίνου μέσω του στόχου για ανάπτυξη προϊόντων που διακόπτουν την διαδικασία της καρκινογένεσης, οι βιολογικοί δείκτες που είναι δυνατόν να συμβάλουν στην καθοδήγηση της στοχευμένης, εξατομικευμένης χρήσης των θεραπευτικών μέσων μας, καθώς και η ασφαλής και αποτελεσματική επισήμανση και θεραπευτική αντιμετώπιση των πρώιμων μεταβολών του νεοπλασματικού μικροπεριβάλλοντος.
Προειδοποιήσεις που αφορούν τις δηλώσεις σχετικά με το μέλλον
Αυτό το δελτίο τύπου περιέχει «δηλώσεις σχετικά με το μέλλον» όπως αυτές καθορίζονται από τον Νόμο του 1995 περί Αναμόρφωσης Δικαστικών Θεμάτων Ιδιωτικών Τίτλων σχετικά με τα αναμενόμενα οφέλη και δυνατότητες ενός προσφάτως εγκεκριμένου προϊόντος. Ο αναγνώστης προειδοποιείται να μην βασίζεται σε αυτές τις δηλώσεις σχετικά με το μέλλον. Αυτές οι δηλώσεις βασίζονται στις τρέχουσες προσδοκίες μελλοντικών συμβάντων. Αν οι υποκείμενες εικασίες αποδειχθούν ανακριβείς ή αν υλοποιηθούν γνωστοί ή άγνωστοι κίνδυνοι ή αβεβαιότητες, τα πραγματικά αποτελέσματα θα μπορούσαν να διαφέρουν ουσιωδώς από τις προσδοκίες και τις προβλέψεις της Janssen-Cilag International NV ή/και της Johnson & Johnson. Οι κίνδυνοι και οι αβεβαιότητες περιλαμβάνουν μεταξύ άλλων τα εξής: αβεβαιότητες που είναι εγγενείς στην έρευνα και την ανάπτυξη προϊόντων, που περιλαμβάνουν την περαιτέρω διερεύνηση του κλινικού οφέλους του προϊόντος∙ την αβεβαιότητα της εμπορικής επιτυχίας∙ ανταγωνισμό, που περιλαμβάνει τις τεχνολογικές προόδους, τα νέα προϊόντα και τις πατέντες που επιτυγχάνουν οι ανταγωνιστές∙ αμφισβήτηση πατέντας∙ προβληματισμούς για την αποτελεσματικότητα ή την ασφάλεια των προϊόντων με αποτέλεσμα τις ανακλήσεις προϊόντων ή τη λήψη μέτρων από τις ρυθμιστικές αρχές∙ αλλαγές στη συμπεριφορά και στα πρότυπα δαπανών ή οικονομική δυσχέρεια των αγοραστών των προϊόντων και των υπηρεσιών υγείας∙ αλλαγές των ισχυόντων νόμων και κανονισμών, που περιλαμβάνουν τις μεταρρυθμίσεις της φροντίδας υγείας σε παγκόσμιο επίπεδο∙ δυσκολίες και καθυστερήσεις στην παραγωγή και τάσεις προς τον περιορισμό των δαπανών για τη φροντίδα υγείας. Ένας επιπλέον κατάλογος και περιγραφή αυτών των κινδύνων, αβεβαιοτήτων και άλλων παραγόντων υπάρχει στην Ετήσια Έκθεση της Johnson & Johnson στο Έντυπο 10-K για το οικονομικό έτος που έληξε στις 3 Ιανουαρίου 2016, στο οποίο περιλαμβάνεται το Έκθεμα 99, καθώς και στις επακόλουθες αναφορές της εταιρείας προς την Επιτροπή Κεφαλαιαγοράς των ΗΠΑ. Αντίγραφα αυτών των αναφορών είναι διαθέσιμα διαδικτυακά στην διεύθυνση www.sec.gov, www.jnj.com ή κατόπιν αιτήματος προς την Johnson & Johnson. Καμία από τις Φαρμακευτικές Εταιρείες Janssen ούτε η Johnson & Johnson δεν αναλαμβάνει να ενημερώσει οποιαδήποτε δήλωση σχετικά με το μέλλον ως αποτέλεσμα νέων πληροφοριών ή μελλοντικών συμβάντων ή εξελίξεων.
Βιβλιογραφία
- Johnson & Johnson. Janssen’s daratumumab accepted for accelerated CHMP assessment for treatment of European patients with heavily pre-treated multiple myeloma. Available at: http://www.jnj.com/news/all/Janssens-daratumumab-accepted-for-accelerated-CHMP-assessment-for-treatment-of-European-patients-with-heavily-pre-treated-multiple-myeloma. Last accessed May 2016.
- Fedele G, di Girolamo M, Recine U, et al. CD38 ligation in peripheral blood mononuclear cells of myeloma patients induces release of protumorigenic IL-6 and impaired secretion of IFNgamma cytokines and proliferation. Mediat Inflamm. 2013;2013:564687.
- Lin P, Owens R, Tricot G, et al. Flow cytometric immunophenotypic analysis of 306 cases of multiple myeloma. Am J Clin Pathol. 2004;121:482-8.
- Santoconito AM, Consoli U, Bagnato S et al. Flow cytometric detection of aneuploid CD38++ plasmacells and CD19+ B-lymphocytes in bone marrow, peripheral blood and PBSC harvest in multiple myeloma patients. Leuk Res. 2004;28:469-77.
- de Weers M, Tai YT, van der Veer MS, et al. Daratumumab, a novel therapeutic human CD38 monoclonal antibody, induces killing of multiple myeloma and other hematological tumors. J Immunol. 2011;186:1840-8.
- DARZALEX® Prescribing Information November 2015. Available at: http://www.accessdata.fda.gov/drugsatfda_docs/label/2015/761036Orig1s000lbledt.pdf. Last accessed May 2016.
- Jansen JH, Bross P, Overdijk MB, et al. Daratumumab, a human CD38 antibody induces apoptosis of myeloma tumor cells via Fc receptor-mediated crosslinking. Blood. 2012;120(21):abstract 2974.
- Overdijk MB, Verploegen S, Bögels M, et al. Antibody-mediated phagocytosis contributes to the anti-tumor activity of the therapeutic antibody daratumumab in lymphoma and multiple myeloma. MAbs 2015;7(2):311-21.
- Krejcik J, Casneuf T, Nijhof I, et al. Immunomodulatory effects and adaptive immune response to daratumumab in multiple myeloma. Blood 2015:126(23):abstract 3037.
- Lonial S, Weiss BM, Usmani SZ, et al. Daratumumab monotherapy in patients with treatment-refractory multiple myeloma (SIRIUS): an open-label, randomised, phase 2 trial. 2016;387:1551-60.
- Lokhorst HM, Plesner T, Laubach JP, et al. Targeting CD38 with daratumumab monotherapy in multiple myeloma. N Engl J Med. 2015;373:1207-19.
- Usmani S, Ahmadi T, Ng Y, et al. Analyses of real world data on overall survival in multiple myeloma patients with at least 3 prior lines of therapy including a PI and an IMiD, or double refractory to a PI and an IMiD. Blood. 2015:126(23):abstract 4498.
- European Medicines Agency. Committee for Medicinal Products for Human Use: Summary of opinion. Available at: http://www.ema.europa.eu/docs/en_GB/document_library/Summary_of_opinion_-_Initial_authorisation/human/004077/WC500203957.pdf. Last accessed May 2016.
- American Society of Clinical Oncology. Multiple myeloma: overview. Available at: http://www.cancer.net/cancer-types/multiple-myeloma/overview. Last accessed May 2016.
- GLOBOCAN 2012. Multiple myeloma. Available at: http://globocan.iarc.fr/old/burden.asp?selection_pop=62968&Textp=Europe&selection_cancer=17270&Text-c=Multiple+myeloma&pYear=13&type=0&window=1&submit=%C2%A0Execute. Last accessed May 2016.
- American Cancer Society. Multiple myeloma: detailed guide. Available at: http://www.cancer.org/acs/groups/cid/documents/webcontent/003121-pdf.pdf. Last accessed May 2016.
- De Angelis R, Minicozzi P, Sant M, et al. Survival variations by country and age for lymphoid and myeloid malignancies in Europe 2000-2007: results of EUROCARE-5 population-based study. Eur J Cancer. 2015;51:2254-68.
- Costa LJ, Gonsalves WI, Kumar SK. Early mortality in multiple myeloma. Leukemia. 2015;29:1616-8.
- Kumar SK, Lee JH, Lahuerta JJ, et al. Risk of progression and survival in multiple myeloma relapsing after therapy with IMiDs and bortezomib: a multicenter international myeloma working group study. Leukemia. 2012;26:149-57.