Η ΚΙΝΗΤΙΚΗ ΤΟΥ ΣΙΔΗΡΟΥ ΚΑΙ Η ΑΞΙΟΛΟΓΗΣΗ ΤΩΝ ΜΕΤΑΒΟΛΩΝ ΤΟΥ
ΠΕΡΙΛΗΨΗ
Η ερυθροποίηση αποτελεί μια πολύπλοκη διαδικασία κατά την οποία οι ημερήσιες απαιτήσεις σε σίδηρο (Fe) για την επαρκή αιμοσφαιρινοποίηση υπολογίζονται σε 20-30mg. Η ημερήσια διαιτητική πρόσληψη Fe ισούται με τις απώλειες, οπότε το μεγαλύτερο μέρος των αναγκών καλύπτεται από την αποδόμηση της αίμης των “γηρασμένων” ερυθροκυττάρων. Ο Fe απαντά στην αποθηκευμένη μορφή (φερριτίνη, αιμοσιδηρίνη), τη λειτουργική μορφή (αιμοσφαιρίνη, μυοσφαιρίνη) και τη μορφή με την οποία μεταφέρεται στους διάφορους ιστούς (τρανσφερρίνη). Στην κινητική του Fe εμπλέκεται ένας αριθμός πρωτεϊνών, οι οποίες συμβάλλουν στη ρύθμιση της ομοιόστασης κατά την απορρόφηση από τον εντερικό βλεννογόνο, κατά την κυκλοφορία του στο πλάσμα και σε κυτταρικό επίπεδο. Η εψιδίνη παράγεται κυρίως στα ηπατοκύττταρα ως απάντηση στα επίπεδα Fe, στη φλεγμονή, στην αναιμία και στην υποξία και αποτελεί την κυριότερη ρυθμιστική πρωτεΐνη. Στην καθημερινή κλινική πράξη η ανάγκη εκτίμησης του μεταβολισμού του Fe είναι συχνή, αφού η σιδηροπενική αναιμία και η αναιμία χρονίας νόσου απαντούν με αυξημένη συχνότητα στο γενικό πληθυσμό. Ο συνδυασμός διαφορετικών εργαστηριακών παραμέτρων είναι απαραίτητος για την ορθή αξιολόγηση της επάρκειας και της χρήσης του Fe, γεγονός που διευκολύνει τη διαγνωστική εκτίμηση και τη θεραπευτική αντιμετώπιση των αναιμιών.
ΕΙΣΑΓΩΓΗ
O Fe είναι στοιχείο απαραίτητο για την επιβίωση όλων των έμβιων όντων. Εκτός από τον κύριο ρόλο του στη μεταφορά και αποθήκευση του οξυγόνου, συμμετέχει σε πλήθος άλλων βιοχημικών διεργασιών, όπως η μεταφορά ηλεκτρονίων στα μιτοχόνδρια, ο μεταβολισμός κατεχολαμινών και η άμυνα του οργανισμού.
Για την εξασφάλιση του φυσιολογικού ρυθμού ερυθροποίησης απαιτείται ίση ποσότητα Fe με αυτή που χάνεται από τα αποπίπτοντα ερυθρά. Η ημερήσια παραγωγή ερυθρών είναι περίπου 200×109, για την επαρκή αιμοσφαιρινοποίηση των οποίων απαιτούνται 20-30mg Fe 1.
Η ΚΑΤΑΝΟΜΗ ΤΟΥ ΣΙΔΗΡΟΥ ΣΤΟΝ ΟΡΓΑΝΙΣΜΟ
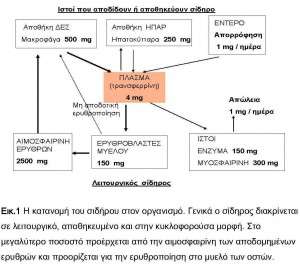
Η συγκέντρωσή του σε υγιείς ενήλικες είναι 50mg/kg στους άνδρες και 40mg/kg στις γυναίκες. Η μεγαλύτερη ποσότητά του βρίσκεται στην αιμοσφαιρίνη, ώστε 450ml ολικού αίματος (1 μονάδα) να περιέχουν 200mg Fe 2. Η υπόλοιπη ποσότητα βρίσκεται με τη μορφή φερριτίνης και αιμοσιδηρίνης, στα κύτταρα του δικτυοενδοθηλιακού συστήματος ΔΕΣ (ήπαρ, σπλήνας, μυελός) και στα παρεγχυματικά κύτταρα του ήπατος 1,3(εικ.1).

Ενώσεις λειτουργικού σιδήρου
Ο λειτουργικός Fe βρίσκεται στην αιμοσφαιρίνη, τη μυοσφαιρίνη και σε ένζυμα στην ελάχιστα διαλυτή οξειδωμένη τρισθενή μορφή Fe 3+ (μη αιμινική) και στην αναχθείσα δισθενή μορφή Fe 2+ (αιμινική) .
Η αιμοσφαιρίνη περιέχει το 65% του Fe του οργανισμού και χρησιμεύει στη μεταφορά του οξυγόνου. Αποτελείται από τέσσερις πεπτιδικές αλυσίδες, κάθε μία από τις οποίες συνδέεται με ένα μόριο αίμης, το οποίο περιέχει ένα άτομο Fe. Ο Fe που απορροφάται, μεταφέρεται από το πλάσμα στο μυελό των οστών, όπου χρησιμοποιείται από τους ερυθροβλάστες για τη σύνθεση της αιμοσφαιρίνης. Τα “γηρασμένα” ερυθροκύτταρα φαγοκυτταρώνονται από τα μακροφάγα και ο Fe της αιμοσφαιρίνης ελευθερώνεται στο πλάσμα για να επαναχρησιμοποιηθεί .
Η μυοσφαιρίνη είναι ερυθρά χρωστική των μυών και περιέχει το 10% του Fe του οργανισμού. Αποτελείται από μία πεπτιδική αλυσίδα συνδεόμενη με ένα μόριο αίμης, η οποία περιέχει ένα άτομο Fe. Η λειτουργία της είναι να αποθηκεύει οξυγόνο που χρησιμοποιείται για τη μυική συστολή.
Το 3% του συνολικού Fe του οργανισμού εμπεριέχεται σε ένζυμα, αιμινικά ή μη, όπως τα κυττοχρώματα, οι καταλάσες, οι υπεροξειδάσες, με πλήθος κυτταρικών λειτουργιών 3.
Πρωτεΐνες μεταφοράς και αποθήκευσης σιδήρου
Ο Fe, λόγω της ικανότητας του να προσλαμβάνει και να αποδίδει ηλεκτρόνια, αναλόγως της τιμή του PH, μπορεί να προκαλέσει στην “ελεύθερη”, οξειδωμένη μορφή του σοβαρές κυτταρικές βλάβες. Για το λόγο αυτό βρίσκεται πάντοτε συνδεδεμένος με διάφορες πρωτεΐνες μεταφοράς και αποθήκευσης.
Η φερριτίνη είναι η κύρια πρωτεΐνη αποθήκευσης του Fe, η οποία συμβάλλει στην ελεγχόμενη απελευθέρωσή του και στην προστασία του από την οξείδωση. Παράγεται από τα κύτταρα του ΔΕΣ στο ήπαρ, σπλήνα και μυελό των οστών και το ερέθισμα για τη σύνθεσή της είναι ο Fe. Η φερριτίνη έχει σφαιρική δομή με διάμετρο 12-13nm, αποτελούμενη από το υδατοδιαλυτό σύμπλεγμα της αποφερριτίνης και το Fe. Η αποφερριτίνη σχηματίζει ένα κέλυφος που αποτελείται από 24 υπομονάδες, H (Heavy) και L (Light), οι οποίες είναι διπλωμένες σε δέσμες 4 ελίκων. Η υδρόφοβη κεντρική κοιλότητα του μορίου με διάμετρο 7-8nm είναι η περιοχή αποθήκευσης του Fe 3+ (ferric state) και μπορεί να περιέχει μέχρι 4.500 άτομα Fe. Ο μηχανισμός διακίνησης του Fe στο μόριο της φερριτίνης δεν έχει αποσαφηνιστεί. Θεωρείται ότι εισέρχεται μέσω έξι υδρόφιλων διαύλων σαν Fe 2+ (ferrous state), στη συνέχεια οξειδώνεται σε Fe 3+ και έτσι παραμένει αποθηκευμένος. Όταν ο οργανισμός χρειάζεται Fe, τότε ανάγεται με τη βοήθεια του ασκορβικού και διυδροφουμαρικού οξέος και εξέρχεται του μορίου 4.
Η αιμοσιδηρίνη είναι πρωτεΐνη αδιάλυτη στο νερό και ορατή στο μικροσκόπιο με τη χρώση Prussian blue (αντίδραση Perl’s). Σε παθολογικές καταστάσεις υπερφόρτωσης με Fe, ο πλεονάζων Fe, αποθηκεύεται στην αιμοσιδηρίνη. Έχει μεγαλύτερη περιεκτικότητα σε Fe σε σχέση με τη φερριτίνη και προκύπτει από την αποδόμηση του περιβλήματος της φερριτίνης στα λυσσοσώματα. Βρίσκεται κυρίως στα μακροφάγα και σε καταστάσεις υπερφόρτωσης σε Fe απαντά σε υψηλή συγκέντρωση και στα ηπατοκύτταρα.
Η τρανσφερρίνη (TF) είναι γλυκοπρωτεΐνη-μεταφορέας του Fe αποτελούμενη από μία πολυπεπτιδική αλυσίδα και βρίσκεται στο πλάσμα και στα υγρά του εξωαγγειακού χώρου. Παράγεται κυρίως στο ήπαρ και η σύνθεσή της είναι αντιστρόφως ανάλογη των αποθηκών Fe. Σε κάθε μόριο της πρωτεΐνης προσδένονται δύο άτομα Fe 3+ ή διαφορετικά 4mg του συνολικού Fe του ορού βρίσκονται με τη μορφή TF. Η TF που δεν είναι συνδεδεμένη με το Fe ονομάζεται απο-τρανσφερρίνη. Η πρόσληψη του Fe από τα κύτταρα γίνεται μέσω του υποδοχέα της TF, TFR1. Πρόκειται για μία διαμεμβρανική πρωτεΐνη με δύο υπομονάδες, σε καθεμία από τις οποίες συνδέεται ένα μόριο TF. Μετά την ενδοκύττωση του συμπλόκου [Fe-TF-TFR1], ο Fe απελευθερώνεται λόγω του όξινου PH στο εσωτερικό των ενδοσωματίων, ανάγεται με τη βοήθεια μιας ρεδουκτάσης (Steap3) και εξέρχεται στο κυτταρόπλασμα μέσω της DMT1. Η TF με τον TFR επιστρέφουν στην επιφάνεια του κυττάρου και επαναχρησιμοποιούνται σε νέο κύκλο. Ο Fe στο κυτταρόπλασμα αποθηκεύεται ή χρησιμοποιείται για τη σύνθεση της αίμης και άλλων πρωτεϊνών. Ο υποδοχέας TFR2 συμμετέχει στο μηχανισμό ομοιόστασης του Fe και στη ρύθμιση της έκκρισης της εψιδίνης 5.
Η ΑΠΟΡΡΟΦΗΣΗ ΚΑΙ Η ΑΝΑΚΥΚΛΩΣΗ ΤΟΥ ΣΙΔΗΡΟΥ
Η απορρόφηση του Fe εξαρτάται από την ποσότητά του στις τροφές, από τη βιοδιαθεσιμότητά του και από τις ανάγκες του οργανισμού. Η δυτική δίαιτα χορηγεί 15 mg Fe ημερησίως με συνήθη ημερησία απορρόφηση 1mg, ενώ σε αυξημένες ανάγκες, λόγω συστηματικής έλλειψης Fe, αναιμίας ή υποξίας, φτάνει τα 3-4 mg 1. Ο Fe των τροφών απελευθερώνεται με τη βοήθεια οξέων και πρωτεολυτικών ενζύμων στο στόμαχο και στο λεπτό έντερο, ενώ ο Fe της αίμης προέρχεται από την αποδόμηση της αιμοσφαιρίνης και της μυοσφαιρίνης. Απορροφάται κυρίως στο δωδεκαδάκτυλο και λιγότερο στη νήστιδα, αφού το αλκαλικό περιβάλλον της τελευταίας οδηγεί στη δημιουργία αδιάλυτων συμπλεγμάτων Fe.
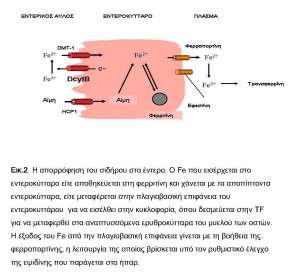
Ο μη αιμινικός Fe των τροφών αποδίδεται σαν Fe 3+ και ανάγεται σε Fe 2+ από το ένζυμο DcytB του κροσσωτού επιθηλίου των εντεροκυττάρων. Ο Fe 2+ μεταφέρεται κατά μήκος των λαχνών του εντερικού βλεννογόνου με τη DMT-1 (ή Nramp2) . Η πρόσληψη του αιμινικού Fe 2+ γίνεται μέσω της πρωτεΐνης HCP1(heme carrier protein 1) που βρέθηκε τελευταία στα εντεροκύτταρα του δωδεκαδακτύλου. Στα εντεροκύτταρα ένα μέρος του Fe 2+ αποθηκεύεται στη φερριτίνη και απομακρύνεται με την απόπτωση των κυττάρων, ενώ ο υπόλοιπος θα μεταφερθεί στο πλάσμα με τη φερροπορτίνη, θα οξειδωθεί σε Fe 3+ με μία φερροξειδάση και τελικώς εισέρχεται στην κυκλοφορία συνδεόμενος με την TF. Η HFE, μια πρωτεΐνη με παρόμοια δομή με το μόριο MHC τάξης Ι, φαίνεται να ρυθμίζει τη μεταφορά του Fe από την πλαγιοβασική επιφάνεια των εντεροκυττάρων στο πλάσμα και οι μεταλλάξεις αυτής εμπλέκονται στην παθογένεια της γενετικής αιμοχρωμάτωσης (εικ.2).

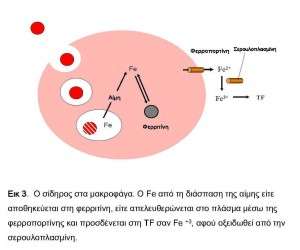
Στα μακροφάγα του σπλήνα με τη φαγοκυττάρωση των “γηρασμένων” ερυθρών, η αιμοσφαιρίνη διασπάται στην αίμη και στις σφαιρινικές αλυσίδες. Η αίμη καταβολίζεται από την οξυγενάση της αίμης (ΗΜΟΧ1) και απελευθερώνεται ο Fe 2+. Το εναπομείναν μόριο της αίμης διασπάται σε CO, το οποίο αποβάλλεται από τους πνεύμονες και σε χολοπρασίνη, η οποία μεταβολίζεται σε χολερυθρίνη. Η μεταφορά του Fe στο κυτταρόπλασμα των μακροφάγων εμπλέκει επίσης την DMT1. Τελικώς ο Fe είτε αποθηκεύεται στη φερριτίνη σαν Fe 3+, είτε περνά στο πλάσμα μέσω της φερροπορτίνης, όπου συνδέεται με την TF μετά από οξείδωση σε Fe 3+. Η απελευθέρωση του Fe από τα μακροφάγα ελέγχεται από την εψιδίνη 1-3(εικ.3).

Η τύχη του Fe που δεσμεύεται στην TF του πλάσματος έχει μελετηθεί με τη βοήθεια του ραδιενεργού 59 Fe. Περίπου το 85% του Fe εισέρχεται στα μιτοχόνδρια των ερυθροβλαστών στο μυελό για τη σύνθεση της αίμης και ακολούθως της αιμοσφαιρίνης. Η επιπλέον ποσότητα Fe στα ερυθρά αποθηκεύεται με τη μορφή φερριτίνης. Έτσι εξηγούνται τα αυξημένα επίπεδα φερριτίνης σε νοσήματα με μειωμένη σύνθεση αιμοσφαιρίνης ή ελαττωματική χρήση Fe (θαλασσαιμίες, σιδηροβλαστική αναιμία) 2.
ΡΥΘΜΙΣΗ ΤΟΥ ΜΕΤΑΒΟΛΙΣΜΟΥ ΤΟΥ ΣΙΔΗΡΟΥ
Η ρύθμιση των επιπέδων Fe γίνεται τόσο κατά τη απορρόφηση από τον εντερικό βλεννογόνο όσο και κατά τη κυκλοφορία στο πλάσμα. Η “κατάσταση του πλάσματος”, όπως εκφράζεται από τον κορεσμό της TF, προγραμματίζει τα επιθηλιακά κύτταρα στις κρύπτες του Lieberkühn να απορροφήσουν την απαραίτητη ποσότητα Fe. Στη γενετική αιμοχρωμάτωση η παραπάνω ρύθμιση δεν επιτυγχάνεται, οπότε παρά τον αυξημένο κορεσμό της TF η απορρόφηση Fe είναι αυξημένη.
Οι ιστοί-δότες Fe π.χ. μακροφάγα, ήπαρ, έντερο, αποδίδουν τόσο Fe στην TF ανάλογα με το διαθέσιμο Fe σε αυτούς, με βασικό στόχο την κάλυψη των αναγκών του μυελού των οστών 1,3.
Η ομοιόσταση του σιδήρου σε κυτταρικό επίπεδο
Η πρόσληψη Fe μέσω του TFR, η ενδοκυττάρια αποθήκευσή του στη φερριτίνη και η ενσωμάτωση του στην αίμη συντονίζονται στο επίπεδο της μεταγραφής και της μετάφρασης με βάση τις απαιτήσεις του οργανισμού σε Fe. Αυτό πραγματοποιείται με την παρουσία ειδικών αλληλουχιών απάντησης στο Fe (iron responsive elements,IREs), που εντοπίζονται σε περιοχές του αγγελιοφόρου mRNA για τη φερριτίνη, τη συνθετάση του δ-αμινολεβουλινικού οξέος (aminolaevulinic acid synthetase, ALA-S) και τον TFR. Τα ένζυμα αυτά, που εμπλέκονται στο μεταβολισμό του Fe, ρυθμίζονται σε επίπεδο μετάφρασης του RNA από τις ρυθμιστικές πρωτεΐνες του κυτταροπλασματικού δικτύου (cytoplasmic iron regulatory proteins, IRPs). Σε περίσσεια Fe οι IRPs εμφανίζουν χαμηλή συγγένεια για τα IRE, οδηγώντας σε μειωμένη σύνθεση υποδοχέα TFR (αναστολή της μετάφρασης) αλλά σε αύξηση της σύνθεσης φερριτίνης και ALA-S των ερυθρών (ευόδωση της μετάφρασης). Αντιθέτως, σε έλλειμμα Fe, η σύνδεση IRP-IRE είναι αυξημένη, οδηγώντας σε αύξηση των TFR και μείωση των επιπέδων της φερριτίνης και της ALA–S 6. Στον πίνακα 1 αναφέρονται συνοπτικά οι κυριότερες πρωτεΐνες που συμμετέχουν στον μεταβολισμό και στην ομοιόσταση του Fe 2.
Η εψιδίνη
Η εψιδίνη είναι ένα πεπτίδιο με 25 αμινοξέα που εντοπίστηκε αρχικά στο πλάσμα και στα ούρα του ανθρώπου. Τα ηπατοκύτταρα είναι ο κύριος τόπος παραγωγής της , ενώ σε χαμηλότερα επίπεδα συντίθεται από βακτήρια με ενεργοποιημένα ουδετερόφιλα. Η βιολογικά δραστική εψιδίνη έχει δομή φουρκέτας με οκτώ κυστεΐνες που δημιουργούν τέσσερις δισουλφιδικούς δεσμούς. Η δομή μοιάζει με αυτή πολλών αντιμικροβιακών πεπτιδίων, ενώ η εψιδίνη in vitro έχει αντιμικροβιακή δραστικότητα. Το γονίδιο της εψιδίνης HAMP στον άνθρωπο έχει τρία εξώνια που κωδικοποιούν ένα πρώιμο μόριο (preprohepcidine) εψιδίνης με 84 αμινοξέα με μία χαρακτηριστική θέση φουρίνης αμέσως μετά το αμινο-τελικό άκρο του τελικού πεπτιδίου 7.
Η εψιδίνη είναι ένας αρνητικός ρυθμιστής της μεταφοράς του Fe στο λεπτό έντερο και στον πλακούντα και επιτείνει τη διατήρηση του Fe στα μακροφάγα του σπληνός. Η συμμετοχή της εψιδίνης στο μεταβολισμό του Fe βασίστηκε στα αποτελέσματα που προέκυψαν από την έλλειψη ή τη περίσσεια Fe σε διαγονιδιακά ποντίκια και επιβεβαιώθηκε με τη μελέτη οικογενειών με σοβαρή νεανική αιμοχρωμάτωση και σύγχρονη έλλειψη εψιδίνης. Η ενέσιμη εψιδίνη προκαλεί 75% μείωση στα επίπεδα Fe στον ορό μέσα σε μία ώρα και το αποτέλεσμα παραμένει περισσότερο από 48 ώρες 7,8,9.
Η ρύθμιση της σύνθεσης της εψιδίνης
Τουλάχιστον τέσσερις παράγοντες εμπλέκονται στη ρύθμιση της έκφρασης της εψιδίνης στον οργανισμό: ο Fe, η υποξία, η αναιμία και οι φλεγμονώδεις κυτοκίνες 9(εικ.4).
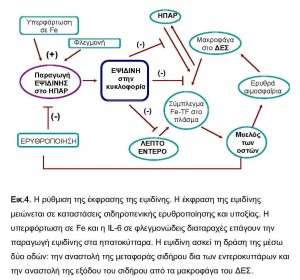

Οι μηχανισμοί ρύθμισης της σύνθεσης της εψιδίνης από το Fe δεν είναι πλήρως γνωστοί μέχρι σήμερα, καθώς το γονίδιο της εψιδίνης δεν φέρει σημεία πρόσδεσης για ρυθμιστές του Fe. Η μελέτη ασθενών με αιμοχρωμάτωση και παθολογική εψιδίνη υποστηρίζει τη συμμετοχή των πρωτεϊνών HJV (hemojuvelin) και του υποδοχέα TFR2. Ο υποδοχέας της μορφογενετικής πρωτεΐνης του οστού BMPR (bone morphogenetic protein, BMP) μπορεί να είναι σημαντικός για τη ρύθμιση της εψιδίνης από το Fe και άλλους διεγέρτες. Η HJV μπορεί να ενεργοπoιήσει το σηματοδοτικό μονοπάτι της BMP, μέσω των BMP1/5/8 οδηγώντας στη σύνθεση εψιδίνης. Οι υποδοχείς TFR1, TFR2, η πρωτεΐνη HFE και HJV καθώς και οι υποδοχείς της μορφογενετικής πρωτεΐνης των οστών, BMPR αλληλεπιδρούν στην επιφάνεια του κυττάρου. Η ισορροπία της σχέσης της HFE με τους TFRs ρυθμίζεται από τη συγκέντρωση της TF. Η αλληλεπίδραση των φωσφορυλιωμένων SMAD 1/5/8 με τη SMAD4 διεγείρει την έκφραση του γονιδίου της εψιδίνης, HAMP 10. Αντιθέτως, η ηπατο-ειδική αφαίρεση της SMAD4, ένα απαραίτητο συστατικό του μονοπατιού σηματοδότησης της BMP, οδηγεί σε σημαντική μείωση της εψιδίνης σε ποντίκια. Ηπατοκύτταρα ανθρώπου και ποντικιού σε καλλιέργεια ανταποκρίνονται στη φλεγμονώδη διέγερση αυξάνοντας το mRNA της εψιδίνης, ενώ η υπερφόρτωση σε Fe σε απομονωμένα πρωτογενή ηπατοκύτταρα δεν επηρεάζει το mRNA της εψιδίνης. Προφανώς πλην των ηπατοκυττάρων και άλλα κύτταρα στον οργανισμό συμμετέχουν στη σιδηρο-εξαρτώμενη ρύθμιση της εψιδίνης 11. Προσφάτως έχει αναγνωριστεί ο ρόλος της ματριπτάσης-2 (matriptase-2, TMPRSS6) στη ρύθμιση του ισοζυγίου του Fe. Πρόκειται για μία σερίνη-πρωτεάση με κύρια θέση παραγωγής το ήπαρ. Οι Silvestri et al. απέδειξαν ότι αποτελεί αρνητικό ρυθμιστή της έκφρασης της εψιδίνης, μέσω της πρωτεολυτικής διάσπασης της HMJ 12 .
Σε κατάσταση υποξίας τα επίπεδα εψιδίνης μειώνονται, ώστε περισσότερος Fe να είναι διαθέσιμος για την αυξημένη ερυθροποιητική δραστηριότητα. Ο υποκινητής του γονιδίου της εψιδίνης στον άνθρωπο περιέχει πολλές θέσεις πρόσδεσης για τον παράγοντα που επηρεάζεται από την υποξία HIF, αν και ο ρόλος τους δεν είναι πλήρως διευκρινισμένος.
Η παραγωγή εψιδίνης στην αναιμία μπορεί να επηρεαστεί από την ιστική υποξία, από τα αυξημένα επίπεδα ερυθροποιητίνης, από την αυξημένη ερυθροποίηση ή από τα επίπεδα ιστικού Fe λόγω της κατανάλωσης του από τον μεγάλο αριθμό πρόδρομων ερυθροκυττάρων. Η αυξημένη ερυθροποιητική δραστηριότητα είναι υπεύθυνη για τα χαμηλά επίπεδα εψιδίνης και την υπερφόρτωση σε Fe σε ασθενείς με ενδιάμεση θαλασσαιμία παρά την υψηλή TF στο πλάσμα. Ο ειδικός διάμεσος παράγοντας μεταξύ της ερυθροποιητικής δραστηριότητας στο μυελό των οστών και της σύνθεσης της εψιδίνης στο ήπαρ δεν είναι ακόμη γνωστός 7,8.
Κατά τη διάρκεια της μόλυνσης και της φλεγμονής, η σύνθεση της εψιδίνης αυξάνεται σημαντικά ανεξάρτητα από τα επίπεδα Fe ή την ερυθροποιητική δραστηριότητα. Από μελέτες σε ποντίκια και στον άνθρωπο, ο άξονας IL-6 – εψιδίνη είναι υπεύθυνος για τα μειωμένα επίπεδα Fe στη φλεγμονή. Πρόσφατα δεδομένα από μελέτες σε ποντίκια επισημαίνουν τον ρόλο των IL-1, TGF-β, BMP1/5/8 χωρίς να έχει ξεκαθαριστεί ο ρόλος τους στο άνθρωπο 9,13.
Μηχανισμός δράσης της εψιδίνης
Η φερροπορτίνη είναι μία πρωτεΐνη–μεταφορέας Fe προς το εξωτερικό του κυττάρου και εκφράζεται σε υψηλά επίπεδα στα εντεροκύτταρα του δωδεκαδακτύλου, στα συγκητιοτροφοβλαστικά κύτταρα του πλακούντα, στα μακροφάγα και στα ηπατοκύτταρα. Η φερροπορτίνη με τη βοήθεια μιας φερροξειδάσης (εφεστίνη στα εντεροκύτταρα και σερουλοπλασμίνη στα μακροφάγα) μεταφέρει τον Fe 3+ στην TF του πλάσματος.
Πρόσφατες μελέτες προτείνουν ότι η εψιδίνη του αίματος αλληλεπιδρά με τα λαχνωτά εντεροκύτταρα και ρυθμίζει το ρυθμό απορρόφησης του Fe με έλεγχο της έκφρασης της φερροπορτίνης στην πλαγιοβασική μεμβράνη. Η σύνδεση της εψιδίνης με τη φερροπορτίνη οδηγεί στην εγκόλπωση και στην αποικοδόμηση της τελευταίας στα λυσσοσώματα. Σε φλεγμονώδεις καταστάσεις ή όταν τα επίπεδα Fe είναι επαρκή ή υψηλά, το ήπαρ παράγει εψιδίνη, η οποία κυκλοφορεί στο λεπτό έντερο και προκαλεί την εγκόλπωση της φερροπορτίνης, εμποδίζοντας τη μεταφορά του Fe στο πλάσμα. Όταν τα επίπεδα Fe είναι χαμηλά, η παραγωγή εψιδίνης καταστέλλεται, οπότε τα μόρια φερροπορτίνης και η απορρόφηση του Fe αυξάνονται. Επιπλέον, η αλληλεπίδραση εψιδίνης–φερροπορτίνης εξηγεί τη ρύθμιση της ανακύκλωσης του Fe στα μακροφάγα. Όταν τα επίπεδα εψιδίνης είναι υψηλά, η εξαγωγή Fe από τα μακροφάγα αναστέλλεται και έτσι εγκλωβίζεται στα μακροφάγα κυρίως του σπληνός 7,8,9.
Η άμεση αλληλεπίδραση της εψιδίνης με τη φερροπορτίνη πιθανώς δεν είναι η μοναδική οδός ρύθμισης της συγκέντρωσης των μορίων της φερροπορτίνης στην κυτταρική μεμβράνη. Υπάρχουν δεδομένα ότι τα επίπεδα mRNA της φερροπορτίνης ρυθμίζονται από το Fe καθαυτό και η εψιδίνη ίσως να έχει δευτερεύοντα ρόλο στην κυτταρική πρόσληψη Fe μέσω αύξησης του ενδοκυττάριου Fe στα εντεροκύτταρα, στα μακροφάγα ή στα ηπατοκύτταρα 11.
ΑΞΙΟΛΟΓΗΣΗ ΤΟΥ ΜΕΤΑΒΟΛΙΣΜΟΥ ΤΟΥ ΣΙΔΗΡΟΥ
Η διάγνωση των διαταραχών του μεταβολισμού του Fe συνάγεται από ένα σύνολο εξετάσεων, έχοντας υπόψη τα στάδια μεταβολισμού και τις μορφές με τις οποίες απαντά στον οργανισμό.
Ο λειτουργικός Fe του οργανισμού μπορεί να εκτιμηθεί από το ιστορικό, την κλινική εικόνα του ατόμου, την τιμή αιμοσφαιρίνης και τους ερυθροκυτταρικούς δείκτες.
Οι αποθήκες Fe μπορούν να αξιολογηθούν από τα επίπεδα φερριτίνης και από την κατανομή των κοκκίων αιμοσιδηρίνης στο μυελό των οστών.
Ο βαθμός μεταφοράς και απόδοσης του Fe στους ιστούς μπορεί να εκτιμηθεί από τα επίπεδα Fe στον ορό, την ολική σιδηροδεσμευτική ικανότητα του ορού (Total Iron Binding Capacity, TIBC), το ποσοστό κορεσμού της TF (Transferrin Saturation, TSAT) και τον διαλυτό υποδοχέα της TF στον ορό (sTFR). Η πρωτοπορφυρίνη και η φερριτίνη των ερυθρών αιμοσφαιρίων δεν παρέχουν επιπλέον διαγνωστικές πληροφορίες και δεν χρησιμοποιούνται στην πράξη. Το ποσοστό των υπόχρωμων ερυθρών, που υπολογίζεται από ορισμένους αναλυτές, αντανακλά το ποσό αιμοσφαιρίνης ανά ερυθρό και αν ξεπεράσει το 6% είναι πρώιμος δείκτης σιδηροπενίας 3,14.
Σε ένα εργαστήριο ρουτίνας οι βασικές βιοχημικές παράμετροι για τη διερεύνηση των διαταραχών του Fe είναι:
• Fe ορού: Η μέτρηση του Fe του ορού αφορά στην πραγματικότητα τον Fe 3+, ο οποίος είναι συνδεδεμένος με την TF. Ο Fe προσδιορίζεται χρωμομετρικά με ή χωρίς την απολευκωμάτωση του ορού, δηλαδή τη φυγοκέντρηση και την απομάκρυνση των κατακρημνισμένων πρωτεϊνών. Η τελευταία μέθοδος είναι απλούστερη, αλλά με κάποια μειονεκτήματα. Συνιστάται οι εξεταζόμενοι να προσέρχονται νηστικοί, αφού πρωτεΐνες και λιπίδια θολώνουν το δείγμα και δίνουν ψευδώς αυξημένες τιμές. Οι φυσιολογικές τιμές του Fe είναι περίπου 50-180 mcg/dL, ενώ δεν πρέπει να παραβλέπεται η ημερήσια διακύμανση των επιπέδων του, με αύξηση των επιπέδων το βράδυ. Σε παθολογικές καταστάσεις, σιδηροπενία ή υπερφόρτωση σε Fe, οι τιμές σταθεροποιούνται σε χαμηλά ή υψηλά επίπεδα αντίστοιχα 15,3.
• Οι τιμές TIBC και TSAT: Υπό φυσιολογικές συνθήκες μόνο το 33% της TF του πλάσματος είναι κορεσμένο με Fe. Η TIBC αποτελεί έμμεσο δείκτη των επιπέδων TF του ορού. Η TSAT προκύπτει από το πηλίκο: [Fe ορού / TIBC ] x 100, και αποτελεί δείκτη της ποσότητας του διαθέσιμου Fe στον οργανισμό για τη σύνθεση της αιμοσφαιρίνης. Οι φυσιολογικές τιμές κορεσμού της TF κυμαίνονται μεταξύ 20 – 50%. Τιμές μικρότερες του 15% θεωρούνται ενδεικτικές σιδηροπενίας, ενώ μπορεί να παρατηρηθούν σε φλεγμονή και λοιμώξεις. Τιμές ανώτερες του 100%, καταδεικνύουν την παρουσία Fe στον ορό, ο οποίος συνδέεται με άλλες πρωτεΐνες, π.χ. αλβουμίνη και όχι μόνο με την TF, αφού αυτή είναι ήδη κορεσμένη. Σταθερά αυξημένα επίπεδα κορεσμού TF πάνω από 50% αποτελούν πρώιμο δείκτη υπερσιδήρωσης 2.
• Φερριτίνη ορού: Ο ποσοτικός προσδιορισμός της φερριτίνης αποτελεί απαραίτητη εξέταση εκτίμησης του μεταβολισμού του Fe. Κατά τη σύνθεση της φερριτίνης ένα πολύ μικρό ποσό απελευθερώνεται στο αίμα. Η συγκέντρωση της φερριτίνης στον ορό του αίματος είναι ανάλογη της ποσότητας του αποθηκευμένου Fe στο ΔΕΣ. Σε συνθήκες αυξημένης απορρόφησης Fe, η παραγωγή φερριτίνης αυξάνει, ώστε να αποθηκεύσει τον πλεονάζοντα Fe. Αντιθέτως στη σιδηροπενία οι αποθήκες Fe “αδειάζουν” πριν την εμφάνιση αναιμίας, δηλαδή η φερριτίνη μειώνεται, ενώ το ποσοστό κορεσμού της TF κυμαίνεται σε φυσιολογικά επίπεδα. Για το λόγο αυτό η φερριτίνη του ορού αποτελεί πρώιμο δείκτη ανίχνευσης σιδηροπενίας. Με το συνδυασμό των μετρήσεων της φερριτίνης του ορού, του Fe του ορού και του TSAT είναι εφικτή η διαφορική διάγνωση μεταξύ σιδηροπενίας και αναιμίας χρονίας νόσου. Να σημειωθεί ωστόσο ότι σε λοιμώξεις, φλεγμονές, κακοήθειες, ηπατοπάθειες, η φερριτίνη λειτουργεί σαν πρωτεΐνη οξείας φάσης και τα επίπεδα της αυξάνονται, χωρίς να αντανακλά τα αποθέματα Fe στον οργανισμό (πίνακας 2) 16. Σήμερα διατίθεται πληθώρα μεθόδων μέτρησης της φερριτίνης, όπως ραδιοανοσολογικές (IRMA και RIA) , ανοσοπροσρόφησης (ELISA), αναλύσεις ανοσοφθορισμού (FIA). Η φερρίτινη δεν υπόκειται σε ημερήσια διακύμανση. Οι φυσιολογικές τιμές ποικίλουν αναλόγως της ηλικίας και του φύλου και κυμαίνονται μεταξύ 30 έως 300 ng/ml 15.
• Ο διαλυτός υποδοχέας sTFR: Ο sTFR που ανιχνεύεται στο πλάσμα είναι ένα μονομερές που προκύπτει από την πρωτεόλυση του υποδοχέα στα ενδοσώματα και αποτελείται από ένα εξωκυττάριο τμήμα του μορίου. Η τιμή αυτή αντανακλά έμμεσα τη συνολική του συγκέντρωση στον οργανισμό και σχετίζεται με τρόπο ανάλογο με το βαθμό της ερυθροποίησης και αντιστρόφως ανάλογο με τα επίπεδα φερριτίνης στον οργανισμό 1. Σε αντίθεση με τον Fe, τη φερριτίνη και την TIBC, η συγκέντρωση του sTFR στον ορό δεν επηρεάζεται ιδιαίτερα σε φλεγμονές, λοιμώξεις, κακοήθειες και συνεπώς είναι σημαντικός δείκτης στη διαφορική διάγνωση της αναιμίας (πίνακας 2). Μπορεί ωστόσο να χρησιμοποιηθεί σαν δείκτης ανταπόκρισης στη θεραπεία με ερυθροποιητίνη των ασθενών με χρόνια νεφρική ανεπάρκεια. Οι τιμές του δεν παρουσιάζουν ημερήσια διακύμανση στον ορό και δεν επηρεάζονται σημαντικά από το φύλο ή την ηλικία ,εκτός από τα νεογνά, όπου τα άρρενα έχουν ελαφρώς υψηλότερες τιμές 15.
ΣΥΜΠΕΡΑΣΜΑ
O Fe αποτελεί ένα βασικό ιχνοστοιχείο απαραίτητο για την αιμοσφαιρινοποίηση, τον οξειδωτικό μεταβολισμό, την κυτταρική ανοσία. Ένας αριθμός ρυθμιστικών μηχανισμών συμμετέχει στην απορρόφηση, στη μεταφορά στους ιστούς, στην αποθήκευση και στην ανακύκλωση του Fe. Τα τελευταία χρόνια έχουν γίνει σημαντικές προσπάθειες για την αναγνώριση των ρυθμιστικών μορίων, για την κατανόηση της έκφρασής τους σε μοριακό επίπεδο και για τη θεραπεία σιδηροεξαρτώνενων αναιμιών με τη χρήση επαγωγέων ή ανταγωνιστών αυτών. Η εργαστηριακή αξιολόγηση του μεταβολισμού του Fe στηρίζεται στη γνώση της ύπαρξης αυτού σε τρεις βασικές μορφές: την αποθηκευτική, τη λειτουργική και τη μεταφερόμενη στο πλάσμα. Η συνδυαστική χρήση παραμέτρων που εκτιμούν την επάρκεια Fe και τη “σιδηροεπαρκή” ερυθροποιητική παραγωγή συμβάλλουν στη διαγνωστική προσέγγιση αναιμικών καταστάσεων.
| Πίνακας 1.Σύνοψη των πρωτεϊνών που συμμετέχουν στην κινητική του σιδήρου | |||
| Πρωτεΐνη | Λειτουργία | Πρωτεΐνη | Λειτουργία |
| DCYTB Duodenal cytochrome-b | Ένζυμο στην μεμβράνη των εντεροκυττάρων, υπεύθυνο για την αναγωγή του σιδήρου από Fe 3+ σε Fe 2+ , ώστε να απορροφηθεί. | Εψιδίνη (HAMP) | Πεπτίδιο αποτελούμενο από 25 αμινοξέα, με γνωστές αντιμικροβιακές ιδιότητες. Έχει βασικό ρόλο στην ομοιόσταση του Fe. |
| DMT-1Divalent metal transporter 1 | Αναφέρεται και σαν DCT1 ή Nramp2. Πρόκειται για γλυκοζυλιωμένη πρωτεΐνη ~90 KDa, που μεταφέρει τον Fe 2+ στο κορυφαίο τμήμα της μεμβράνης των εντεροκυττάρων και συμμετέχει στην απελευθέρωση του σιδήρου από το ενδόσωμα. | BMP Μορφογενετική πρωτεΐνη των οστών | Η μορφογενετική πρωτεΐνη των οστών συμμετέχει σε μία σειρά αντιδράσεων που επηρεάζουν την έκφραση του γονιδίου HAMP της εψιδίνης. |
| FPN Φερροπορτίνη | Αναφέρεται και σαν IREG-1 (iron-regulated transporter-1) ή MTP1 (metal transport protein 1). Πρόκειται για διαμεμβρανική πρωτεΐνη ~ 62KDa , με λειτουργική αλληλουχία IRE στο 5’ άκρο. Είναι υπεύθυνη για την έξοδο του Fe από την πλαγιοβασική επιφάνεια της μεμβράνης των εντεροκυττάρων και την απελευθέρωσή του από τα ηπατοκύτταρα και τα μακροφάγα. | HFE | Πρωτεΐνη με δομή ανάλογη των πρωτεϊνών του μείζονος συμπλέγματος ιστοσυμβατότητας. Εκφράζεται σε χαμηλές συγκεντρώσεις σε όλους σχεδόν τους ιστούς. Δημιουργεί σύμπλοκο με τον TFR1 και παίζει ρόλο στη μεταφορά και την ομοιόσταση του σιδήρου Οι μεταλλάξεις του γονιδίου σχετίζονται με την γενετική αιμοχρωμάτωση τύπου 1. |
| TF Τρανσφερρίνη | Πρόκειται για την κύρια πρωτεΐνη –μεταφορέα του Fe στο πλάσμα. Είναι γλυκοπρωτεΐνη ~80 KDa με κύρια θέση σύνθεσης το ήπαρ. Πλην του Fe προσδένει με χαμηλή συγγένεια τα: Mn, Co, Cu, Cd. | HJV Haemojuvelin | Η ακριβής λειτουργία του μορίου είναι άγνωστη. Φαίνεται να λειτουργεί ως συν-υποδοχέας της ΒMP2. Εκφράζεται στο ήπαρ, στην καρδιά και στους σκελετικούς μυς και η έκφρασή της συνδέεται με την εψιδίνη. Οι μεταλλάξεις του γονιδίου σχετίζονται με τη νεανική αιμοχρωμάτωση τύπου 2. |
| TFR1Υποδοχέας TF 1 | Υποδοχέας πρόσληψης του σιδήρου που έχει προσδεθεί στην TF. Είναι ομοδιμερής γλυκοπρωτεΐνη ~ 90 KDa , που εκφράζεται στα περισσότερα κύτταρα πλην των ώριμων ερυθρών. Η αλληλεπίδραση TFR1-TF είναι αναστρέψιμη και εξαρτάται από το pH και την περιεκτικότητα του Fe. | IREIron regulatory elements | Πρόκειται για δομές τύπου “θηλιάς” στις μη κωδικοποιούσες αλληλουχίες του RNA. |
| TFR2Υποδοχέας TF 2 | Ο υποδοχέας της τρανσφερρίνης 2 έχει κατά 66% ομοιότητα στην αλληλουχία αμινοξέων με τον TFR1. Βρίσκεται στην πλαγιοβασική επιφάνεια της μεμβράνης των ηπατοκυττάρων. Συμμετέχει στην ομοιόσταση του σιδήρου, χωρίς να ανταγωνίζεται τον TFR1 στη μεταφορά του. | IRP1 και IRP2Iron regulatory binding proteins | Προσδένονται στις αλληλουχίες IRE και ελέγχουν την έκφραση γονιδίων που συμμετέχουν στην ομοιόσταση του σιδήρου, όπως της φερριτίνης, της 5-ALA-συνθετάσης, του Nramp2, της FPN, του DMT1 και του TFR1. |
| STEAP3Six transmembrane epithelial antigen of the prostate-3 | Πρόκειται για μία αναγωγάση στα ενδοσώματα, υπεύθυνη για την πρόσληψη του Fe, του προσδεμένου στην TF, στα κύτταρα της ερυθράς σειράς. | Φερροξειδάση (Hephaestin, εφεστίνη) | Οξειδάση στην πλαγιοβασική επιφάνεια της μεμβράνης των εντεροκυττάρων, δομικώς ανάλογη της σερουλοπλασμίνης. Συμμετέχει στην απόδοση του Fe+3 στην κυκλοφορία. |
| Φερριτίνη | Αποτελεί την κυριότερη αποθηκευτική μορφή του σιδήρου με ευρεία κατανομή στον οργανισμό. Αποτελείται από 24 υπομονάδες με ποικίλλη αναλογία L και Η αλυσίδων. | Σερουλοπλασμίνη | Πρωτεΐνη με ιδιότητα οξειδάσης, η οποία περιέχει το 95% του Cu του οργανισμού. Είναι γλυκοπρωτεΐνη ~132 KDa, που δρα σε συνδυασμό με τη φερροπορτίνη στην απελευθέρωση του σιδήρου στην κυκλοφορία και στην ομοιόστασή του. |
| Αιμοσιδηρίνη | Αποτελεί αποθήκη σιδήρου και προέρχεται από την αποδόμηση της φερριτίνης σε καταστάσεις περίσσειας σιδήρου. | Μιτοφερρίνη MTFN | Μεταφέρει τον Fe στα μιτοχόνδρια, όπου ενσωματώνεται στην πρωτοπορφυρίνη ΙΧ για τη σύνθεση της αίμης. |
| Οξυγενάση της αίμης | Συμμετέχει στον καταβολισμό της αίμης στα μακροφάγα, αντίδραση κατά την οποία απελευθερώνεται ο Fe της αίμης. | ΕρυθροποιητίνηEPO | Αυξάνει την έκφραση της φερροπορτίνης στα μακροφάγα, του TFR1 στους ερυθροβλάστες, των DMT1 και hephaestin στα εντεροκύτταρα.Μειώνει την έκφραση της εψιδίνης στο ηπατοκύτταρα και της DMT1 στα μακροφάγα. |
| Πίνακας 2.1 Μεταβολές των παραμέτρων αξιολόγησης της σιδηροκινητικής σε παθολογικές καταστάσεις | |||
| Φυσιολογικές τιμές | Σιδηροπενική αναιμία | Αναιμία χρονίας νόσου | |
| MCVMCH | 80-100fl28-35pg | M | Μ ή Φ |
| Fe ορού | 50-180mcg/dL | M | Μ |
| TIBC | 240-450mcg/dL | A | Μ ή Φ |
| TSAT | 20-50% | M | Μ |
| Φερριτίνη | 30-300ng/ml | M | Φ ή Α |
| sTFR | 0.76-1.76mg/L | A | Φ |
| Fe στο μυελό | 2-3+ | M | Φ ή Α |
| Fe στους ερυθροβλάστες | 20-80% | M | Μ |
| Φ: φυσιολογικό, Μ: μείωση, Α: αύξηση, MCV: μέσος όγκος ερυθρών, MCH: μέση ποσότητα αιμοσφαιρίνης, Fe: σίδηρος, TIBC: ολική σιδηροδεσμευτική ικανότητα, TSAT: κορεσμός τρανσφερρίνης, sTFR: διαλυτοί υποδοχείς της τρανσφερρίνης | |||
| Πίνακας 2.2 Μεταβολές των παραμέτρων αξιολόγησης της σιδηροκινητικής σε παθολογικές καταστάσεις | |||
| Σιδηροπενία & αναιμία χρονίας νόσου | Θαλασσαιμία | Σιδηροβλαστική αναιμία | |
| MCVMCH | Μ | Μ | Μ (συγγενής)Φ ή Α (επίκτητη) |
| Fe ορού | Μ | Φ | Α |
| TIBC | Φ ή Μ | Φ | Φ |
| TSAT | Φ ή Μ | Φ | Α |
| Φερριτίνη | Φ ή Μ | Φ | Α |
| sTFR | Α | Φ | Φ ή Α |
| Fe στο μυελό | Μ | Φ | Φ ή Α |
| Fe στους ερυθροβλάστες | Μ | Φ | Δακτυλιοειδείς σιδηροβλάστες >15% |
| Φ: φυσιολογικό, Μ: μείωση, Α: αύξηση, MCV: μέσος όγκος ερυθρών, MCH: μέση ποσότητα αιμοσφαιρίνης, Fe: σίδηρος, TIBC: ολική σιδηροδεσμευτική ικανότητα, TSAT: κορεσμός τρανσφερρίνης, sTFR: διαλυτοί υποδοχείς της τρανσφερρίνης | |||
ΒΙΒΛΙΟΓΡΑΦΙΑ
1. Muñoz M, Villar I, et al. An update on iron physiology. World J Gastroenterol. 2009; 15: 4617-4626
2. Nadadur SS, Srirama K, et al. Iron transport & homeostasis mechanisms: Their role in health & disease. Indian J Med Res. 2008; 128: 533-544
3. Worwood M, Hoffbrand V. Iron metabolism, iron deficiency and disorders of haem synthesis. AV Hoffbrand, Postgraduate Haematology. 2005: 26-43, Blackwell
4. Fleming RE, Bacon BR. Orchestration of iron homeostasis. N Engl J Med. 2005; 352: 1741-4
5. Huebers HA, Finch CA. The physiology of transferrin and transferrin receptors. Physiol Rev. 1987; 67: 520-582
6. Iolascon A, Luigia De Falco, Carole Beaumont. Molecular basis of inherited microcytic anemia due to defects in iron acquisition or heme synthesis. Haematologica. 2009; 94: 395-408.
7. Piperno A, Mariani R, Trombini P, et al. Hepcidin modulation in human diseases: From research to Clinic. World J Gastroenterol. 2009; 15 : 538-551
8. Young B, Zaritsky J. Hepcidin for clinicians. Clin J Am Soc Nephrol. 2009; 4:1384-7
9. Herbert Y. Lin. Erythropoiesis: The Roles of Erythropoietin and Iron. Textbook of Nephro-Endocrinology. 2009: 19-26, Elsevier
10. Fleming MD. The Regulation of Hepcidin and Its Effects on Systemic and Cellular Iron Metabolism. Hematology Education Book. 2008: 151-158
11. Κόλλια Π. Ο μεταβολισμός του σιδήρου και οι διαταραχές του. Τόμος Πρακτικών Ημερίδας ΕΑΕ, 2007: 7-15
12. Ramsay AJ, Hooper JD, Folgueras AR, et al. Matriptase-2 (TMPRSS6): a proteolytic regulator of iron homeostasis. Haematologica. 2009; 94: 840-849
13. Weiss G, Goodnough LT. Anemia of chronic disease. N Engl J Med. 2005; 352: 1011-23
14. Morón C, Viteri F. Update on common indicators of nutritional status: food access, food consumption, and biochemical measures of iron and anemia. Nutrition Reviews. 2009; 67: 31– 35
15. Γυπαράκι Μ. Ο μεταβολισμός του σιδήρου και οι διαταραχές του. Τόμος Πρακτικών Ημερίδας ΕΑΕ, 2007: 156-165
16. Zuckerman KS. Approach to the anemias. Goldman: Cecil Medicine. 2007; chapter:162, Elsevier